Exubera för behandling av diabetes
Varumärke: Exubera
Generiskt namn: människa insulin
Doseringsform: inandningspulver
Innehåll:
Beskrivning
Klinisk farmakologi
Kliniska studier
Indikationer och användning
Kontra
varningar
försiktighetsåtgärder
Läkemedelsinteraktioner
Negativa reaktioner
överdosering
Dosering och administrering
Hur levereras
Exubera, humant insulin [rDNA-ursprung] Patientinformation (på vanligt engelska)
Beskrivning
Exubera® består av blåsor som innehåller humant insulininhalationspulver, som administreras med Exubera® Inhalator. Exubera-blister innehåller humant insulin producerat med rekombinant DNA-teknik med användning av en icke-patogen laboratoriestam av Escherichia coli (K12). Kemiskt sett har humant insulin den empiriska formeln C257H383N65O77S6 och en molekylvikt av 5808. Humant insulin har följande primära aminosyrasekvens:
Exubera (humant insulin [rDNA-ursprung]) Inhalationspulver är ett vitt till benvitt pulver i en enhetsdosblister (fyllmassa, se tabell 1). Varje enhetsdosblister av Exubera innehåller 1 mg eller 3 mg dos insulin (se tabell 1) i a homogen pulverformulering innehållande natriumcitrat (dihydrat), mannitol, glycin och natrium hydroxid. Efter att en Exubera-blister har satts in i inhalatorn, pumpar patienten inhalatorns handtag och trycker sedan på en knapp, vilket gör att blåsan stickas in. Insulininhalationspulvret sprids sedan in i kammaren, vilket gör att patienten kan andas in det aerosoliserade pulvret.
Under standardiserade in vitro-testförhållanden levererar Exubera en specifik utsöndrad dos av insulin från inhalatorns munstycke (se tabell 1). En fraktion av den totala partikelmassan avges som fina partiklar som kan nå den djupa lungan. Upp till 45% av innehållet på 1 mg blister, och upp till 25% av innehållet i 3 mg blister, kan förvaras i blåsan.
Tabell 1: Dosnomenklatur och information
| Fyll massan (mg pulver) |
Nominell dos (mg insulin) |
Emission Dose*,†(mg insulin) |
Fin partikeldosc,†(mg insulin) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Den faktiska mängden insulin som levereras till lungan beror på enskilda patientfaktorer, till exempel inspirerande flödesprofil. In vitro påverkas emissioner av aerosolmätvärden vid flödeshastigheter över 10 L / min.
topp
Klinisk farmakologi
Handlingsmekanism
Insulinens primära aktivitet är reglering av glukosmetabolism. Insulin sänker blodglukoskoncentrationerna genom att stimulera perifert glukosupptag av skelettmuskulatur och fett, och genom att hämma glukosproduktion i lever. Insulin hämmar lipolys i adipocyten, hämmar proteolys och förbättrar proteinsyntesen.
farmakokinetik
Absorption
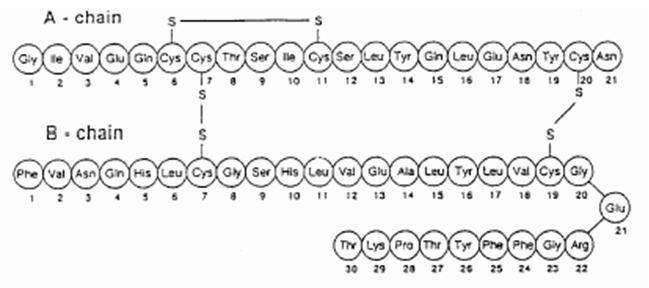
Exubera levererar insulin genom oral inandning. Insulinet absorberas lika snabbt som subkutant administrerat snabbverkande insulinanaloger och snabbare än subkutant administrerat vanligt humant insulin hos friska försökspersoner och hos patienter med typ 1 eller typ 2-diabetes (se Figur 1).
Figur 1: Genomsnittliga förändringar i fritt insulinserumkoncentrationer (µU / ml) hos patienter med följande typ 2-diabetes Administration av enstaka doser av inhalerat insulin från Exubera (6 mg) och subkutant regelbundet humant insulin (18U)
I kliniska studier på patienter med typ 1 och typ 2-diabetes nådde seruminsulin, efter inandning av Exubera, högsta koncentration snabbare än efter subkutan injektion av vanlig humant insulin, 49 minuter (intervall 30 till 90 minuter) jämfört med 105 minuter (intervall 60 till 240 minuter), respektive.
I kliniska studier minskade absorptionen av subkutant regelbundet humant insulin med ökande patientmassaindex (BMI). Absorptionen av insulin efter inandning av Exubera var emellertid oberoende av BMI.
I en studie på friska personer, systemisk insulinutsättning (AUC och Cmax) efter administrering av Exubera ökade med dos över ett intervall från 1 till 6 mg vid administrering som kombinationer av 1 och 3 mg blåsor.
I en studie där doseringsformen av tre 1 mg blister jämfördes med en 3 mg blister, Cmax och AUC efter administrering av tre 1 mg blister var ungefär 30% respektive 40% större än efter administrering av en 3 mg blister (se DOSERING OCH ADMINISTRERING).
Distribution och eliminering
Eftersom rekombinant humant insulin är identiskt med endogent insulin, förväntas den systemiska fördelningen och elimineringen vara desamma. Detta har emellertid inte bekräftats för Exubera.
farmakodynamik
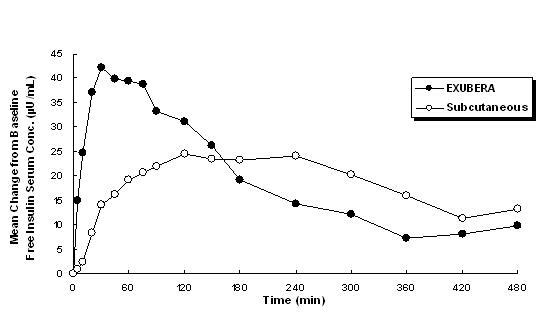
Exubera har, liksom subkutant administrerat snabbverkande insulinanaloger, en snabbare början av glukos-sänkande aktivitet än subkutant administrerat vanligt humant insulin. Hos friska frivilliga var varaktigheten av glukossänkande aktivitet för Exubera jämförbar med subkutant administrerat regelbundet humant insulin och längre än subkutant administrerat snabbverkande insulinanaloger (se Figur 2).
figur 2. Genomsnittlig glukosinfusionshastighet (GIR) Normaliserad till GIRmax för varje ämne Behandling kontra tid hos friska frivilliga
* Bestämd som mängd glukos infunderad för att upprätthålla konstanta plasmaglukoskoncentrationer, normaliserade till maximala värden (procent av maximala värden); indikerar insulinaktivitet.
När Exubera inhaleras inträffar inträde av glukos-sänkande aktivitet hos friska frivilliga inom 10-20 minuter. Den maximala effekten på glukos sänkning utövas ungefär 2 timmar efter inandning. Varaktigheten för glukos-sänkande aktivitet är cirka 6 timmar.
Hos patienter med typ 1 eller typ 2-diabetes har Exubera en större glukos-sänkande effekt de första två timmarna efter dosering jämfört med subkutant administrerat vanligt humant insulin.
Variationen inom ämnet mellan Exuberas glukossänkande aktivitet är vanligtvis jämförbar med den för subkutant administrerat vanlig humant insulin hos patienter med typ 1 och 2-diabetes.
Särskilda befolkningar
Pediatriska patienter
Hos barn (6-11 år) och ungdomar (12-17 år) med typ 1-diabetes var tid till maximal insulinkoncentration för Exubera uppnådd snabbare än för subkutan vanligt humant insulin, vilket överensstämmer med observationer hos vuxna patienter med typ 1 diabetes.
Geriatriska patienter
Det finns inga synliga skillnader i Exuberas farmakokinetiska egenskaper vid jämförelse av patienter över 65 år och yngre vuxna patienter.
Kön
Hos personer med och utan diabetes observerades inga synliga skillnader i farmakokinetiska egenskaper hos Exubera mellan män och kvinnor.
Lopp
En studie utfördes på 25 friska kaukasiska och japanska icke-diabetiska personer för att jämföra farmakokinetiska och farmakodynamiska egenskaper hos Exubera kontra subkutan injektion av vanlig människa insulin. De farmakokinetiska och farmakodynamiska egenskaperna hos Exubera var jämförbara mellan de två populationerna.
Fetma
Absorptionen av Exubera är oberoende av patientens BMI.
Nedsatt njurfunktion
Effekten av nedsatt njurfunktion på farmakokinetiken för Exubera har inte studerats. Noggrann glukosövervakning och dosjustering av insulin kan vara nödvändig hos patienter med nedsatt njurfunktion (se FÖRSIKTIGHETSÅTGÄRDER, Nedsatt njurfunktion).
Nedsatt leverfunktion
Effekten av nedsatt leverfunktion på farmakokinetiken för Exubera har inte studerats. Noggrann glukosövervakning och dosjustering av insulin kan vara nödvändig hos patienter med leverdysfunktion (se FÖRSIKTIGHETSÅTGÄRDER).
Graviditet
Absorptionen av Exubera hos gravida patienter med graviditet och före graviditet typ 2-diabetes var förenlig med den hos icke-gravida patienter med diabetes typ 2 (se FÖRSIKTIGHETSÅTGÄRDER).
Rökning
Hos rökare förväntas den systemiska insulineksponeringen för Exubera vara 2 till 5 gånger högre än hos icke-rökare. Exubera är kontraindicerat till patienter som röker eller som har slutat röka mindre än 6 månader innan Exubera-behandlingen påbörjas. Om en patient börjar eller återupptar rökning måste Exubera avbrytas omedelbart på grund av den ökade risken för hypoglykemi, och en alternativ behandling måste användas (se KONTRA).
I kliniska studier av Exubera hos 123 patienter (av vilka 69 var rökare) upplevde rökare en snabbare början av glukos-sänkande verkan, större maximal effekt och en större total glukossänkande effekt (särskilt under de första 2-3 timmarna efter dosering), jämfört med icke-rökare.
Passiv cigarettrök
Till skillnad från ökningen i insulinexponering efter aktiv rökning, när Exubera administrerades till 30 friska icke-rökare frivilliga efter 2 timmars exponering för passiv cigarettrök i en kontrollerad experimentell inställning, minskades AUC och Cmax insulin med cirka 20% och 30%, respektive. Farmakokinetiken för Exubera har inte studerats hos icke-rökare som kroniskt utsätts för passiv cigarettrök.
Patienter med underliggande lungsjukdomar
Användning av Exubera till patienter med underliggande lungsjukdom, såsom astma eller KOL, rekommenderas inte eftersom säkerheten och effekten av Exubera i denna population inte har fastställts (se VARNINGAR). Användningen av Exubera är kontraindicerat hos patienter med instabil eller dåligt kontrollerad lungsjukdom på grund av bred variationer i lungfunktion som kan påverka absorptionen av Exubera och öka risken för hypoglykemi eller hyperglykemi (se KONTRA).
I en farmakokinetisk studie på 24 icke-diabetiska personer med mild astma, absorberades insulin efter administrering av Exubera, i frånvaro av behandling med en bronkodilator, var ungefär 20% lägre än absorptionen som observerats hos individer utan astma. I en studie på 24 icke-diabetiska patienter med kronisk obstruktiv lungsjukdom (KOL) var emellertid det systemiska exponeringen efter administrering av Exubera var ungefär två gånger högre än hos vanliga personer utan KOLS (se FÖRSIKTIGHETSÅTGÄRDER).
Administrering av albuterol 30 minuter före administrering av Exubera hos icke-diabetiska personer med både mild astma (n = 36) och måttligt astma (n = 31) resulterade i en genomsnittlig ökning av AUC och Cmax insulin mellan 25 och 50% jämfört med när Exubera administrerades ensamt (se FÖRSIKTIGHETSÅTGÄRDER).
topp
Kliniska studier
Säkerheten och effekten av Exubera har studerats hos cirka 2500 vuxna patienter med typ 1 och typ 2-diabetes. Den primära effektivitetsparametern för de flesta studier var glykemisk kontroll, mätt genom reduktionen från baslinjen i hemoglobin A1c (HbA1c).
Diabetes typ 1
En 24-veckors, slumpmässig, öppen etikett, aktiv kontrollstudie (studie A) genomfördes hos patienter med typ 1-diabetes för att bedöma säkerheten och effekten av Exubera administreras före måltid tre gånger dagligen (TID) med en enda nattinjektion av Humulin® U Ultralente® (humaninsulinförlängd zinksuspension) (n = 136). Komparatorbehandlingen administrerades subkutant vanlig humant insulin två gånger dagligen (BID) (före frukost och förmiddag) med BID-injektion av NPH humant insulin (humaninsofan-suspension) (n = 132). I denna studie var medelåldern 38,2 år (intervall: 20-64) och 52% av individerna var manliga.
En andra 24-veckors, randomiserad, öppen etikett, aktiv kontrollstudie (studie B) genomfördes hos patienter med typ 1-diabetes för att utvärdera säkerhet och effekt av Exubera (n = 103) jämfört med subkutant regelbundet humant insulin (n = 103) vid administrering av TID före måltider. I båda behandlingsarmarna administrerades NPH humant insulin BID (på morgonen och vid sänggåendet) som basalinsulin. I denna studie var medelåldern 38,4 år (intervall: 19-65) och 54% av försökspersonerna var manliga.
I varje studie var reduktionen i HbA1c och hastigheterna för hypoglykemi jämförbara för de två behandlingsgrupperna. Exubera-behandlade patienter hade en större minskning av fastande plasmaglukos än patienter i jämförande grupp. Andelen patienter som når en HbA1c-nivå på <8% (per American Diabetes Association-behandlingsåtgärd) Nivå vid tidpunkten för studiens genomförande) och en HbA1c-nivå på <7% var jämförbar mellan de två behandlingsgrupperna. Resultaten för studier A och B visas i tabell 2.
Tabell 2: Resultat från två 24-veckors aktiva kontroller, öppna etikettundersökningar hos patienter med typ 1-diabetes (studier A och B)
| Studie A | Studie B | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Provstorlek | 136 | 132 | 103 | 103 |
| UL = Humulin® U Ultralente®; SC R = subkutant vanlig humant insulin | ||||
| ||||
| HbA1c (%) | ||||
| Basvärde | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. genomsnittlig förändring från baslinjen | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera minus SC R* | 0.14 | -0.11 | ||
| 95% CI för behandlingsskillnad | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Fastande plasmaglukos (mg / dL) | ||||
| Basvärde | 191 | 198 | 178 | 191 |
| Adj. genomsnittlig förändring från baslinjen | -32 | -6 | -23 | 13 |
| Exubera minus SC R | -27 | -35 | ||
| 95% CI för behandlingsskillnad | (-47, -6) | (-58, -13) | ||
| 2 timmars glukoskoncentration efter prandial (mg / dL) | ||||
| Basvärde | 283 | 305 | 273 | 293 |
| Adj. genomsnittlig förändring från baslinjen | -21 | 14 | -1 | -3 |
| Exubera minus SC R | -35 | 2 | ||
| 95% CI för behandlingsskillnad | (-61, -8) | (-29, 32) | ||
| Patienter med slutet av studien HbA1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Patienter med slutet av studien HbA1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Kroppsvikt | ||||
| Basvärde (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. medelförändring från baslinjen (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera minus SC R | -0.72 | -0.24 | ||
| 95% CI för behandlingsskillnad | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Studiens slut dagliga insulindos | ||||
| Kortverkande insulin | 13,4 mgc | 18.3 IU | 10,9 mgc | 25,7 IE |
| Långverkande insulin | 26,4 IU | 37,1 IU | 31,5 IE | 31,9 IE |
Diabetes typ 2
Monoterapi hos patienter som inte kontrolleras optimalt med kost- och träningsbehandling
En 12-veckors, randomiserad, öppen etikett, aktiv kontrollstudie (studie C) genomfördes på patienter med typ 2-diabetes inte optimalt kontrollerad med kost och motion, bedöma säkerheten och effekten av TID Exubera före måltid (n = 75) jämfört med en insulin-sensibiliserande medel. I denna studie var medelåldern 53,7 år (intervall: 28-80), 55% av individerna var manliga och medelkroppsindexet var 32,3 kg / m2.
Efter 12 veckor, HbA1c nivåerna hos patienter som behandlades med Exubera minskade 2,2% (SD = 1,0) från en baslinje på 9,5% (SD = 1,1). Andelen patienter som behandlats med Exubera uppnådde ett slut på studien HbA1c nivå <8% ökade till 82,7%. Andelen patienter som behandlats med Exubera uppnådde ett slut på studien HbA1c nivå av
Monoterapi och tilläggsterapi hos patienter som tidigare behandlats med oral oral terapi
En 12-veckors, randomiserad, öppen etikett, aktiv kontrollstudie (studie D) genomfördes på patienter med typ 2 diabetes som för närvarande fick behandling men som var dåligt kontrollerade med två orala medel (OA). Baslinje-OA inkluderade en insulinsekretagog och antingen metformin eller en tiazolidindion. Patienter randomiserades till en av tre armar: fortsätter OA-terapi ensam (n = 96), bytte till TID Exubera monoterapi före måltid (n = 102) eller TID Exubera före måltid till fortsatt OA-terapi (n = 100). I denna studie var medelåldern 57,4 år (intervall: 33-80), 66% av försökspersonerna var manliga och medelkroppsindexet var 30 kg / m2.
Exubera monoterapi och Exubera i kombination med OA-terapi var överlägsna OA-terapi enbart för att minska HbA1c nivåer från baslinjen. Hastighetsnivån för hypoglykemi för de två Exubera-behandlingsgrupperna var något högre än i OA-terapigruppen ensam. Jämfört med OA-terapi enbart, andelen patienter som når en HbA1c nivå <8% (per American Diabetes Association-behandlingsåtgärd vid studietid) och en HbA1c nivån på <7% var högre för patienter som behandlades med Exubera monoterapi och Exubera i kombination med OA-terapi. Patienter i båda Exubera-behandlingsgrupperna hade större minskningar av fastande plasmaglukos än patienter som behandlades med OA-terapi enbart. Resultaten för studie D visas i tabell 3.
Tabell 3: Resultat från en 12-veckors, aktiv-kontroll, öppen etikettundersökning hos patienter med typ 2-diabetes som inte är optimalt kontrollerad med dubbel oral oral terapi (studie D)
| Studie D | Exubera monoterapi | OA* | Exubera + OA |
|---|---|---|---|
| Provstorlek | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Basvärde | 9.3 | 9.3 | 9.2 |
| Adj. genomsnittlig förändring från baslinjen | -1.4 | -0.2 | -1.9 |
| Exuberagrupp minus OA†| -1.18†,c, § | -1.67†, ¶, § | |
| 95% CI för behandlingsskillnad | (-1.41, -0.95) | (-1.90, -1.44) | |
| Fastande plasmaglukos (mg / dL) | |||
| Basvärde | 203 | 203 | 195 |
| Adj. genomsnittlig förändring från baslinjen | -23 | 1 | -53 |
| Exuberagrupp minus OA | -24c | -53 ¶ | |
| 95% CI för behandlingsskillnad | (-36, -11) | (-66, -41) | |
| Patienter med slutet av studien HbA1c < 8%# | 55.9% | 18.8% | 86.0% |
| Patienter med slutet av studien HbA1c < 7% | 16.7% | 1.0% | 32.0% |
| Kroppsvikt | |||
| Basvärde (kg) | 89.5 | 88.0 | 88.6 |
| Adj. medelförändring från baslinjen (kg) | 2.8 | 0.0 | 2.7 |
| Exuberagrupp minus OA | 2.80c | 2.75 ¶ | |
| 95% CI för behandlingsskillnad | (1.94, 3.65) | (1.89, 3.61) |
En 24-veckors, randomiserad, öppen etikett, aktiv-kontrollstudie (studie E) genomfördes hos patienter med typ 2-diabetes, som för närvarande fick sulfonylurea-terapi. Denna studie utformades för att utvärdera säkerheten och effekten av tillsatsen av Exubera före måltid för att fortsätta sulfonylurea-terapi (n = 214) jämfört med tillsatsen av metformin före måltid till fortsatt sulfonylurea-terapi (n = 196). Individer stratifierades enligt deras HbA1c vid vecka -1. Två skikt definierades: ett lågt HbA1c-skikt (HbA1c â € ¥ 8% till â ‰ ¤9,5%) och en hög HbA1c stratum (HbA1c > 9,5 till â ‰ 12%).
Exubera i kombination med sulfonylurea var överlägset metformin och sulfonylurea vid reducering av HbA1c-värden från baslinjen i gruppen med höga stratum. Exubera i kombination med sulfonylurea var jämförbart med metformin i kombination med sulfonylurea för att reducera HbA1c-värden från baslinjen i gruppen med låga skikt. Graden av hypoglykemi var högre efter tillsatsen av Exubera till sulfonylurea än efter tillsatsen av metformin till sulfonylurea. Procentandelen patienter som uppnådde mål HbA1c-värden på 8% och 7% var jämförbar mellan behandlingsgrupperna i båda lagen, liksom minskning av fastande plasmaglukos (se Tabell 4).
En annan 24-veckors, randomiserad, öppen etikett, aktiv kontrollstudie (studie F) genomfördes på patienter med typ 2-diabetes, som för närvarande fick metforminbehandling. Denna studie utformades för att utvärdera säkerheten och effekten av tillsatsen av Exubera före måltid för att fortsätta metforminbehandling (n = 234) jämfört med tillsatsen av glibenklamid före måltid till fortsatt metforminbehandling (n = 222). Ämnen i denna studie stratifierades också till ett av två skikt enligt definitionen i studie E.
Exubera i kombination med metformin var överlägsen glibenklamid och metformin för att reducera HbA1c värden från baslinjen och uppnå mål HbA1c värden i gruppen med högt stratum. Exubera i kombination med metformin var jämförbart med glibenklamid i kombination med metformin för att reducera HbA1c värden från baslinjen och uppnå mål HbA1c värden i gruppen med lågt skikt. Graden av hypoglykemi var något högre efter tillsatsen av Exubera till metformin än efter tillsatsen av glibenklamid till metformin. Minskningen av fastande plasmaglukos var jämförbar mellan behandlingsgrupperna (se Tabell 4).
Tabell 4: Resultat från två 24-veckors aktiva kontroller, öppna etikettundersökningar hos patienter med typ 2-diabetes tidigare i oral oral terapi (studier E och F)
| Studie E | Studie F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Träffade*+ SU* | Exubera + SU* | Träffade*+ SU* | Exubera + Met* | Gli* + Met* | Exubera + Met* | Gli* + Met* | |
| Högt stratum†| Låg stratum†| Högt stratum†| Låg stratum†| |||||
| Provstorlek | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Basvärde | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. genomsnittlig förändring från baslinjen | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera minus OAc | -0.38c, § | -0.07 | -0.37c, ¶ | 0.04 | ||||
| 95% CI för behandlingsskillnad | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Fastande plasmaglukos (mg / dL) | ||||||||
| Basvärde | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Genomsnittlig förändring från baslinjen | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera minus OA | 1 | 4 | -2 | 4 | ||||
| 95% CI för behandlingsskillnad | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Ämnen med slutet av studien HbA1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Ämnen med slutet av studien HbA1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Kroppsvikt | ||||||||
| Basvärde (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. medelförändring från baslinjen (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera minus OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% CI för behandlingsskillnad | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Användning hos patienter som tidigare behandlats med subkutan insulin
En 24-veckors, randomiserad, öppen etikett, aktiv kontrollstudie (studie G) genomfördes hos insulinbehandlade patienter med typ 2 diabetes för att bedöma säkerheten och effekten av Exubera administrerat TID före måltid med en enda injektion på natten Humulin® U Ultralente® (n = 146) jämfört med subkutant vanligt humant insulin administrerat BID (före frukost och före middagen) med BID-injektion av NPH humant insulin (n = 149). I denna studie var medelåldern 57,5 år (intervall: 23-80), 66% av individerna var manliga och medelkroppsindexet var 30,3 kg / m2.
Minskningarna från baslinjen i HbA1cprocent av patienterna som når en HbA1c nivå <8% (per American Diabetes Association-behandlingsåtgärd vid studietid) och en HbA1c nivån <7%, liksom hastigheterna för hypoglykemi, var likartade mellan behandlingsgrupper. Exubera-behandlade patienter hade en större minskning av fastande plasmaglukos än patienter i jämförande grupp. Resultaten för studie G visas i tabell 5.
Tabell 5: Resultat från en 24-veckors, aktiv-kontroll, öppen etikettundersökning hos patienter med typ 2-diabetes som tidigare behandlats med subkutan insulin (studie G)
| Studie G | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Provstorlek | 146 | 149 |
| UL = Humulin® U Ultralente®; SC R = subkutant vanlig humant insulin | ||
| ||
| HbA1c (%) | ||
| Basvärde | 8.1 | 8.2 |
| Adj. genomsnittlig förändring från baslinjen | -0.7 | -0.6 |
| Exubera minus SC R* | -0.07 | |
| 95% CI för behandlingsskillnad | (-0.31, 0.17) | |
| Fastande plasmaglukos (mg / dL) | ||
| Basvärde | 152 | 159 |
| Adj. genomsnittlig förändring från baslinjen | -22 | -6 |
| Exubera minus SC R | -16.36 | |
| 95% CI för behandlingsskillnad | (-27.09, -5.36) | |
| Patienter med slutet av studien HbA1c < 8%†| 76.0% | 69.1% |
| Patienter med slutet av studien HbA1c < 7% | 45.2% | 32.2% |
| Kroppsvikt | ||
| Basvärde (kg) | 90.6 | 89.0 |
| Adj. medelförändring från baslinjen (kg) | 0.1 | 1.3 |
| Exubera minus SC R | -1.28 | |
| 95% CI för behandlingsskillnad | (-1.96, -0.60) | |
| Studiens slut dagliga insulindos | ||
| Kortverkande insulin | 16,6 mgc | 25,5 IE |
| Långverkande insulin | 37,9 IE | 52,3 IE |
topp
Indikationer och användning
Exubera är indicerat för behandling av vuxna patienter med diabetes mellitus för kontroll av hyperglykemi. Exubera har en början av verkan som liknar snabbverkande insulinanaloger och har en varaktighet av glukosesänkande aktivitet jämförbar med subkutant administrerat vanligt humant insulin. Hos patienter med typ 1-diabetes bör Exubera användas i regimer som innehåller ett längre verkande insulin. Hos patienter med typ 2-diabetes kan Exubera användas som monoterapi eller i kombination med orala medel eller längre verkande insuliner.
topp
Kontra
Exubera är kontraindicerat hos patienter som är överkänsliga för Exubera eller ett av dess hjälpämnen.
Exubera är kontraindicerat till patienter som röker eller som har slutat röka mindre än 6 månader innan Exubera-behandlingen påbörjas. Om en patient börjar eller återupptar rökning måste Exubera avbrytas omedelbart på grund av den ökade risken för hypoglykemi, och en alternativ behandling måste användas (se KLINISK FARMAKOLOGI, Specialpopulationer, Rökning). Säkerheten och effekten av Exubera hos patienter som röker har inte fastställts.
Exubera är kontraindicerat hos patienter med instabil eller dåligt kontrollerad lungsjukdom på grund av stora variationer vid lungfunktion som kan påverka absorptionen av Exubera och öka risken för hypoglykemi eller hyperglykemi.
topp
varningar
Exubera skiljer sig från vanligt humant insulin genom dess snabba effekt. Vid användning som måltidsinsulin ska dosen av Exubera ges inom tio minuter före en måltid.
Hypoglykemi är den vanligaste biverkningen av insulinbehandling, inklusive Exubera. Tidpunkten för hypoglykemi kan skilja sig mellan olika insulinformuleringar.
Patienter med typ 1-diabetes behöver också ett längre verkande insulin för att upprätthålla adekvat glukoskontroll.
Alla förändringar av insulin bör göras försiktigt och endast under medicinsk övervakning. Förändringar i insulinstyrka, tillverkare, typ (t.ex. regelbunden, NPH, analoger) eller arter (djur, människa) kan resultera i behovet av en dosändring. Samtidig oral antidiabetisk behandling kan behöva justeras.
Glukosövervakning rekommenderas för alla patienter med diabetes.
På grund av effekten av Exubera på lungfunktionen, bör alla patienter ha en lungfunktion bedömd innan behandling med Exubera påbörjas (se FÖRSIKTIGHETSÅTGÄRDER: Lungfunktion).
Användning av Exubera till patienter med underliggande lungsjukdom, såsom astma eller KOL, rekommenderas inte eftersom säkerheten och effekten av Exubera i denna population inte har fastställts (se FÖRSIKTIGHETSÅTGÄRDER: Underliggande lungsjukdom).
I kliniska studier av Exubera har det funnits 6 nydiagnostiserade fall av primär lungmalignitet bland Exubera-behandlade patienter och 1 nydiagnostiserade fall bland komparatorbehandlade patienter. Det har också förekommit en postmarknadsföringsrapport om en primär lungmalignitet hos en Exubera-behandlad patient. I kontrollerade kliniska studier av Exubera var förekomsten av ny primär lungcancer per 100 patientår av exponering för läkemedelsstudier 0,13 (5 fall över 3900 patientår) för Exubera-behandlade patienter och 0,02 (1 fall under 4100 patientår) för komparatorbehandlade patienter. Det fanns för få fall för att avgöra om uppkomsten av dessa händelser har samband med Exubera. Alla patienter som fick diagnosen lungcancer hade en tidigare historia av cigarettrökning.
topp
försiktighetsåtgärder
Allmän
Som med alla insulinpreparat kan tiden för Exubera-verkan variera i olika individer eller vid olika tidpunkter hos samma individ. Justering av dosering av vilket insulin som helst kan vara nödvändigt om patienter ändrar sin fysiska aktivitet eller sin vanliga måltidsplan. Insulinbehov kan förändras under samtidiga tillstånd som sjukdom, känslomässiga störningar eller stress.
hypoglykemi
Som med alla insulinpreparat kan hypoglykemiska reaktioner vara associerade med administreringen av Exubera. Snabba förändringar i serumglukoskoncentrationer kan orsaka symtom som liknar hypoglykemi hos personer med diabetes, oavsett glukosvärde. Tidiga varningssymptom på hypoglykemi kan vara annorlunda eller mindre uttalade under vissa förhållanden, till exempel länge varaktighet av diabetes, diabetisk nervsjukdom, användning av mediciner såsom betablockerare eller intensifierad diabeteskontroll (ser FÖRSIKTIGHETSÅTGÄRDER: Läkemedelsinteraktioner). Sådana situationer kan leda till svår hypoglykemi (och möjligen förlust av medvetande) innan patienternas medvetenhet om hypoglykemi.
Nedsatt njurfunktion
Studier har inte utförts på patienter med nedsatt njurfunktion. Liksom med andra insulinpreparat kan doskraven för Exubera minskas hos patienter med nedsatt njurfunktion (se KLINISK FARMAKOLOGI, Specialpopulationer).
Nedsatt leverfunktion
Studier har inte utförts på patienter med nedsatt leverfunktion. Liksom för andra insulinpreparat kan doskraven för Exubera minskas hos patienter med nedsatt leverfunktion (se KLINISK FARMAKOLOGI, Specialpopulationer).
Allergi
Systemisk allergi
I kliniska studier var den totala förekomsten av allergiska reaktioner hos patienter som behandlades med Exubera liknande den hos patienter som använde subkutana regimer med vanlig humant insulin.
Liksom med andra insulinpreparat kan sällsynta, men potentiellt allvarliga, generell allergi mot insulin uppstå, vilket kan orsaka utslag (inklusive pruritus) över hela kroppen, andnöd, andning, andning i blodtrycket, snabb puls eller svettas. Allvarliga fall av generaliserad allergi, inklusive anafylaktiska reaktioner, kan vara livshotande. Om sådana reaktioner inträffar från Exubera, bör Exubera stoppas och alternativa behandlingar övervägas.
Antikroppsproduktion
Insulinantikroppar kan utvecklas under behandling med alla insulinpreparat inklusive Exubera. I kliniska studier av Exubera där komparatorn var subkutan insulin ökade nivåerna av insulinantikroppar (vilket återspeglas i analyser av insulinbindningsaktivitet) var signifikant större för patienter som fick Exubera än för patienter som fick subkutant insulin endast. Inga kliniska konsekvenser av dessa antikroppar identifierades under tidsperioden för kliniska studier av Exubera; den långsiktiga kliniska betydelsen av denna ökning av antikroppsbildning är emellertid okänd.
Respiratory
Lungefunktion
I kliniska studier upp till två års varaktighet visade patienter som behandlades med Exubera en större minskning av lungfunktionen, specifikt den tvingade expirationsvolymen på en sekund (FEV1) och kolmonoxiddiffusionsförmågan (DLCO), än jämförande-behandlade patienter. Den genomsnittliga behandlingsgruppskillnaden i lungfunktion som gynnade komparatorgruppen noterades inom de första flera veckorna av behandlingen med Exubera och förändrades inte under den tvååriga behandlingsperioden (Ser NEGATIVA REAKTIONER: Lungfunktion).
Under de kontrollerade kliniska studierna upplevde enskilda patienter märkbara minskningar av lungfunktionen i båda behandlingsgrupperna. En minskning från FEV1 från baslinjen på 20% vid den senaste observationen inträffade hos 1,5% av Exubera-behandlade och 1,3% av de komparatorbehandlade patienterna. En nedgång från baslinjen DLCO av â € 20% vid den senaste observationen inträffade hos 5,1% av Exubera-behandlade och 3,6% av de komparatorbehandlade patienterna.
På grund av effekten av Exubera på lungfunktionen bör alla patienter bedömas med spirometri (FEV1) innan behandlingen med Exubera påbörjas. Bedömning av DLCO bör övervägas. Effekten och säkerheten av Exubera hos patienter med FEV-baslinje1 eller DLCO <70% förutspådd har inte fastställts och användningen av Exubera i denna population rekommenderas inte.
Bedömning av lungfunktion (t.ex. spirometri) rekommenderas efter de första 6 månaderna av terapin och därefter årligen, även i frånvaro av lungsymtom. Hos patienter som har en minskning med â € 20% i FEV1 från baslinjen, bör lungfunktionstester upprepas. Om "20% -nedgången från FEV1-baslinjen bekräftas, bör Exubera avbrytas. Förekomsten av lungsymtom och mindre minskningar av lungfunktionen kan kräva mer frekvent övervakning av lungfunktionen och överväga att avbryta Exubera.
Underliggande lungsjukdom
Användning av Exubera hos patienter med underliggande lungsjukdom, såsom astma eller KOL, rekommenderas inte eftersom effekten och säkerheten för Exubera i denna population inte har fastställts.
bronkospasm
Bronkospasm har sällan rapporterats hos patienter som tar Exubera. Patienter som upplever en sådan reaktion bör avbryta Exubera och omedelbart söka medicinsk utvärdering. Omadministrering av Exubera kräver en noggrann riskbedömning och bör endast göras under noggrann medicinsk övervakning med lämpliga kliniska faciliteter tillgängliga.
Interkurrent andningssjukdom
Exubera har administrerats till patienter med interkurrent respiratorisk sjukdom (t.ex. bronkit, övre luftvägsinfektioner, rinit) under kliniska studier. Hos patienter som upplever dessa tillstånd avbröt 3-4% tillfälligt Exubera-behandling. Det fanns ingen ökad risk för hypoglykemi eller försämrad glykemisk kontroll som observerades hos patienter som behandlades med Exubera jämfört med patienter som behandlades med subkutan insulin. Under respiratorisk sjukdom i respiratorisk luft, kan noggrann övervakning av blodsockerkoncentrationer och dosjustering krävas.
Information för patienter
Patienter bör instrueras i självhanteringsprocedurer inklusive glukosövervakning; korrekt Exubera inhalationsteknik; och hantering av hypoglykemi och hyperglykemi. Patienter måste instrueras i hantering av speciella situationer som till exempel strömförhållanden (sjukdom, stress eller emotionell) störningar), en otillräcklig eller överhoppad insulindos, oavsiktlig administrering av en ökad insulindos, otillräckligt matintag, eller hoppade måltider.
Patienterna bör informeras om att i kliniska studier var behandling med Exubera associerad med små, icke-progressiva medelminskningar i lungfunktionen relativt komparatorbehandlingar. På grund av effekten av Exubera på lungfunktionen rekommenderas lungfunktionstester innan behandlingen med Exubera påbörjas. Efter inledande av terapin rekommenderas periodiska lungfunktionstest (se FÖRSIKTIGHETSÅTGÄRDER Andningsorgan, lungfunktion).
Patienter bör informera sin läkare om de har tidigare haft lungsjukdom, eftersom användning av Exubera inte rekommenderas i patienter med underliggande lungsjukdom (t.ex. astma eller KOL) och är kontraindicerat hos patienter med dåligt kontrollerad lunga sjukdom.
Kvinnor med diabetes bör uppmanas att informera sin läkare om de är gravida eller överväger graviditet.
topp
Läkemedelsinteraktioner
Ett antal ämnen påverkar glukosmetabolismen och kan behöva justering av insulindos och särskilt noggrann övervakning.
Följande är exempel på ämnen som kan minska den blodsockersänkande effekten av insulin som kan leda till hyperglykemi: kortikosteroider, danazol, diazoxid, diuretika, sympatomimetiska medel (t.ex. epinefrin, albuterol, terbutalin), glukagon, isoniazid, fenotiazinderivat, somatropin, sköldkörtelhormoner, östrogener, gestagener (t.ex. i orala preventivmedel), proteashämmare och atypiska antipsykotiska läkemedel (t.ex. olanzapin och klozapin).
Följande är exempel på ämnen som kan öka den blodsockersänkande effekten av insulin och känsligheten för hypoglykemi: oral antidiabetika, ACE-hämmare, disopyramid, fibrater, fluoxetin, MAO-hämmare, pentoxifylline, propoxyfen, salicylater och sulfonamid antibiotika.
Betablockerare, klonidin, litiumsalter och alkohol kan antingen öka eller minska insulinens blodsockersänkande effekt. Pentamidin kan orsaka hypoglykemi, som ibland kan följas av hyperglykemi.
Dessutom, under påverkan av sympatolytiska läkemedel såsom beta-blockerare, klonidin, guanetidin och reserpin, kan tecknen och symtomen på hypoglykemi reduceras eller saknas.
Bronkodilatorer och andra inhalerade produkter kan förändra absorptionen av inhalerat humant insulin (se KLINISK FARMAKOLOGI, Speciella befolkningar). Konsekvent tidpunkt för dosering av bronkodilatorer i förhållande till administrering av Exubera, noggrann övervakning av blodglukoskoncentrationer och dostitrering i förekommande fall rekommenderas.
Karcinogenes, mutagenes, nedsatt fertilitet
Tvååriga karcinogenicitetsstudier på djur har inte utförts. Insulin var inte mutagent i Ames bakteriella omvänd mutationstest i närvaro och frånvaro av metabolisk aktivering.
Hos Sprague-Dawley-råttor genomfördes en 6-månaders toxicitetsstudie med upprepad dos med insulininhalationspulver i doser upp till 5,8 mg / kg / dag (jämfört med den kliniska startdos på 0,15 mg / kg / dag var den höga dosen av råttor 39 gånger eller 8,3 gånger den kliniska dosen, baserat på antingen en mg / kg eller en jämförelse av kroppsytan på mg / m2). Hos Cynomolgus-apor genomfördes en 6-månaders toxicitetsstudie med upprepad dos med inhalerat insulin i doser upp till 0,64 mg / kg / dag. Jämfört med den kliniska startdosen på 0,15 mg / kg / dag var den höga apan 4,3 gånger eller 1,4 gånger den kliniska dosen, baserat på antingen en mg / kg eller en mg / m2 kroppsytajämförelse. Dessa var maximalt tolererade doser baserade på hypoglykemi.
Jämfört med kontrolldjur fanns det inga behandlingsrelaterade biverkningar hos varken arter på lungfunktion, grov eller mikroskopisk morfologi i luftvägarna eller bronkiallymfkörtlarna. På liknande sätt fanns det ingen effekt på cellproliferationsindex i alveolära eller bronkiolära områden i lungan hos någon av arterna.
Eftersom rekombinant humant insulin är identiskt med det endogena hormonet, genomfördes inte reproduktions- / fertilitetsstudier på djur.
Graviditet
Teratogena effekter
Graviditet kategori C
Djurens reproduktionsstudier har inte genomförts med Exubera. Det är inte känt om Exubera kan orsaka fosterskada när det ges till en gravid kvinna eller om Exubera kan påverka reproduktionskapaciteten. Exubera ska ges till en gravid kvinna endast om det är klart nödvändigt.
Ammande mödrar
Många läkemedel, inklusive humant insulin, utsöndras i bröstmjölk. Av denna anledning bör försiktighet iakttas när Exubera ges till en ammande kvinna. Patienter med diabetes som ammar kan behöva justeringar av Exubera-dosen, måltidsplanen eller båda.
Pediatrisk användning
Långsiktig säkerhet och effektivitet av Exubera hos barn har inte fastställts (se KLINISK FARMAKOLOGI, Speciella befolkningar).
Geriatrisk användning
I kontrollerade fas 2/3 kliniska studier (n = 1975) administrerades Exubera till 266 patienter â € 65 år och 30 patienter â € 75 år. Majoriteten av dessa patienter hade typ 2-diabetes. Förändringen i HbA1C och hastigheten för hypoglykemi skilde sig inte efter ålder.
topp
Negativa reaktioner
Säkerheten för Exubera ensam, eller i kombination med subkutan insulin eller orala medel, har varit utvärderades hos cirka 2500 vuxna patienter med typ 1 eller typ 2-diabetes som utsattes för Exubera. Cirka 2000 patienter exponerades för Exubera i mer än 6 månader och mer än 800 patienter exponerades i mer än 2 år.
Icke-respiratoriska biverkningar
Icke-respiratoriska biverkningar rapporterade hos â% 1 av 1977 Exubera-behandlade patienter i kontrollerade fas 2/3 kliniska studier, oavsett orsakssamband, inkluderar (men är inte begränsade till) följande:
Metabolisk och näringsmässig: hypoglykemi (se VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER)
Kroppen som helhet: bröstsmärta
Klyvning: torr mun
Speciella sinnen: otitis media (typ 1 pediatriska diabetiker)
hypoglykemi
Hastigheterna och förekomsten av hypoglykemi var jämförbara mellan Exubera och subkutant vanlig humant insulin hos patienter med typ 1 och typ 2-diabetes. I typ 2-patienter som inte kontrollerades tillräckligt med terapi med en enda oral substans, tillägg av Exubera associerades med en högre hastighet av hypoglykemi än tillsatsen av en andra oral ombud.
Bröstsmärta
Ett antal olika bröstsymptom rapporterades som biverkningar och grupperades under den icke-specifika termen bröstsmärta. Dessa händelser inträffade hos 4,7% av Exubera-behandlade patienter och 3,2% av patienterna i jämförande grupper. Majoriteten (> 90%) av dessa händelser rapporterades som milda eller måttliga. Två patienter i Exubera och en i jämförande grupp avbröt behandlingen på grund av bröstsmärta. Förekomsten av biverkningar som orsakade all kausalitet relaterade till kranskärlssjukdom, såsom angina pectoris eller hjärtinfarkt var jämförbara i Exubera (0,7% angina pectoris; 0,7% hjärtinfarkt) och komparator (1,3% angina pectoris; 0,7% hjärtinfarkt) behandlingsgrupper.
Torr mun
Muntorrhet rapporterades hos 2,4% av de Exubera-behandlade patienterna och 0,8% av patienterna i jämförande grupper. Nästan alla (> 98%) rapporterade munntorrhet var milda eller måttliga. Inga patienter avbröt behandlingen på grund av muntorrhet.
Öronhändelser hos barndiabetiker
Pediatriska diabetiker av typ 1 i Exubera-grupper upplevde biverkningar relaterade till örat oftare än pediatriska diabetiker av typ 1 i behandlingsgrupper som endast fick subkutant insulin. Dessa händelser inkluderade otitis media (Exubera 6,5%; SC 3,4%), öronsmärta (Exubera 3,9%; SC 1,4%) och öronsjukdom (Exubera 1,3%; SC 0%).
Andningsbiverkningar
Tabell 6 visar förekomsten av andningsbiverkningar för varje behandlingsgrupp som rapporterades i â 1 ¥ av någon behandlingsgrupp i kontrollerade fas 2 och 3 kliniska studier, oavsett orsakssamband.
Tabell 6: Andningsbiverkningar i luftvägar rapporterade i â% 1 av alla behandlingsgrupper i kontrollerade fas 2 och 3 kliniska studier, oavsett orsak
| Procent av patienter som rapporterar händelse | |||||
|---|---|---|---|---|---|
| Negativ händelse | Diabetes typ 1 | Diabetes typ 2 | |||
| Exubera N = 698 |
SC N = 705 |
Exubera N = 1279 |
SC N = 488 |
OA N = 644 |
|
| SC = subkutan insulinkomparator; OA = orala medelkomparatorer | |||||
| Luftvägsinfektion | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Hosta ökad | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Faryngit | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| rinit | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Bihåleinflammation | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Andningsstörning | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| dyspné | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Sputum ökade | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Bronkit | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Astma | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| näsblod | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Laryngit | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| lunginflammation | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Röständring | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Hosta
I tre kliniska studier rapporterade patienter som slutförde en hostefrågeformulär att hosta tenderade att uppstå inom sekunder till minuter efter Exubera inandning, var övervägande milt i svårighetsgrad och var sällan produktiv i natur. Förekomsten av denna hosta minskade med fortsatt Exubera-användning. I kontrollerade kliniska studier avbröts 1,2% av patienterna Exubera-behandling på grund av hosta.
dyspné
Nästan alla (> 97%) av dyspné rapporterades som mild eller måttlig. Ett litet antal Exubera-behandlade patienter (0,4%) avslutade behandlingen på grund av dyspné jämfört med 0,1% av de komparatorbehandlade patienterna.
Andra biverkningar i andningsorganen - faryngit, ökad sputum och epistax
Majoriteten av dessa händelser rapporterades som milda eller måttliga. Ett litet antal Exubera-behandlade patienter avslutade behandlingen på grund av faryngit (0,2%) och sputum ökade (0,1%); inga patienter avbröt behandlingen på grund av epistax.
Lungefunktion
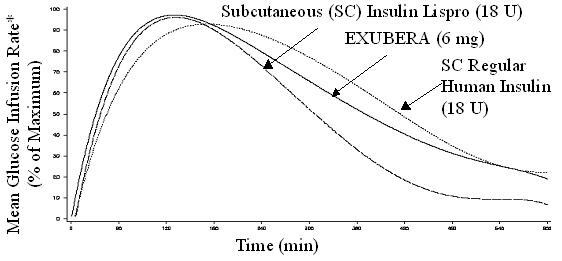
Effekten av Exubera på andningsorganen har utvärderats hos över 3800 patienter i kontrollerade fas 2 och 3 kliniska studier (där 1977 patienter behandlades med Exubera). I randomiserade, öppna kliniska studier upp till två års varaktighet, patienter behandlade med Exubera visade en större minskning av lungfunktionen, speciellt den tvingade expirationsvolymen hos en andra (FEV1) och kolmonoxiddiffusionsförmågan (DLCO), än jämförda patienter. De genomsnittliga behandlingsgruppskillnaderna i FEV1 och DLCO, noterades inom de första veckorna av behandlingen med Exubera och fortsatte inte under den tvååriga behandlingsperioden. I en avslutad kontrollerad klinisk prövning på patienter med typ 2-diabetes efter två års behandling med Exubera, visade patienter upplösning av skillnaden i behandlingsgrupp i FEV1 sex veckor efter avslutad behandling. Upplösning av effekten av Exubera på lungfunktionen hos patienter med diabetes typ 1 har inte studerats efter långvarig behandling.
Figurerna 3 till 6 visar den genomsnittliga FEV1 och DLCO förändring från baslinjen mot tiden från två pågående randomiserade, öppna, tvååriga studier på 580 patienter med typ 1 och 620 patienter med typ 2-diabetes.
Figur 3: Ändring från baslinjen FEV1 (L) hos patienter med diabetes typ 1 (medelvärde +/- standardavvikelse)
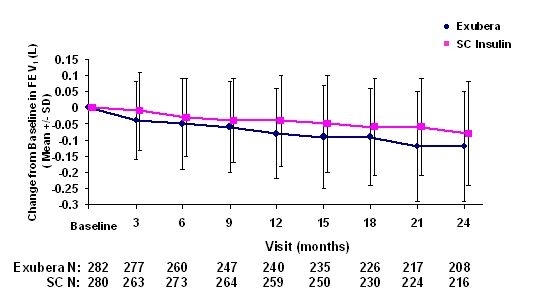
Figur 4: Ändring från baslinjen FEV1 (L) hos patienter med typ 2-diabetes (medelvärde +/- standardavvikelse)

Efter två års Exubera-behandling hos patienter med typ 1 och typ 2-diabetes är skillnaden mellan behandlingsgrupper för den genomsnittliga förändringen från baslinjen FEV1 var ungefär 40 ml, vilket gynnade komparator.
Figur 5: Ändring från baslinje DLco (ml / min / mmHg) hos patienter med typ 1-diabetes (medelvärde +/- standardavvikelse)
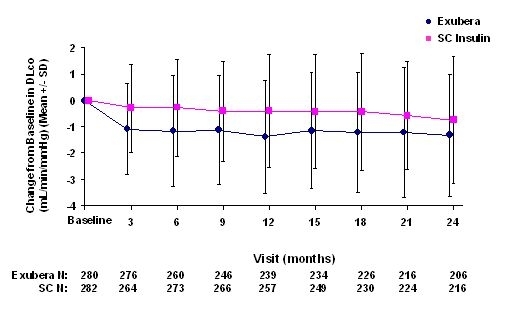
Figur 6: Ändring från baslinje DLco (ml / min / mmHg) hos patienter med typ 2-diabetes (medelvärde +/- standardavvikelse)
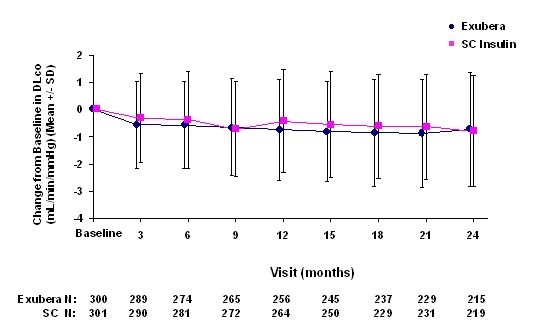
Efter 2 års Exubera-behandling var skillnaden mellan behandlingsgrupper för genomsnittlig förändring från baslinjen DLCO var ungefär 0,5 ml / min / mmHg (typ 1-diabetes), vilket gynnade komparatorn och ungefär 0,1 ml / min / mmHg (typ 2-diabetes), vilket gynnade Exubera.
Under de tvååriga kliniska studierna upplevde enskilda patienter märkbara minskningar av lungfunktionen i båda behandlingsgrupperna. En minskning från FEV: s baslinje1 av â € 20% vid den senaste observationen inträffade i 1,5% av Exubera-behandlade och 1,3% av de komparatorbehandlade patienterna. En nedgång från baslinjen DLCO av â € 20% vid den senaste observationen inträffade hos 5,1% av Exubera-behandlade och 3,6% av de komparatorbehandlade patienterna.
topp
överdosering
Hypoglykemi kan uppstå som ett resultat av ett överskott av insulin i förhållande till matintag, energiförbrukning eller båda.
Milda till måttliga avsnitt av hypoglykemi kan vanligtvis behandlas med oral glukos. Justeringar i läkemedelsdosering, måltidsmönster eller träning kan behövas.
Allvarliga episoder av hypoglykemi med koma, krampanfall eller neurologisk nedsättning kan behandlas med intramuskulär / subkutan glukagon eller koncentrerad intravenös glukos. Fortsatt intag av kolhydrater och observation kan vara nödvändigt eftersom hypoglykemi kan återkomma efter uppenbar klinisk återhämtning.
topp
Dosering och administrering
Exubera har, liksom snabbverkande insulinanaloger, en snabbare början av glukos-sänkande aktivitet jämfört med subkutant injicerat vanligt humant insulin. Exubera har en varaktighet av glukosesänkande aktivitet jämförbar med subkutant injicerat vanlig humant insulin och längre än snabbverkande insulin. Exuberadoser bör administreras omedelbart före måltiderna (högst 10 minuter före varje måltid).
Hos patienter med typ 1-diabetes bör Exubera användas i regimer som innehåller ett längre verkande insulin. För patienter med typ 2-diabetes kan Exubera användas som monoterapi eller i kombination med orala medel eller längre verkande insulin.
På grund av effekten av Exubera på lungfunktionen, bör alla patienter ha en lungfunktion utvärderad innan behandlingen med Exubera påbörjas. Periodisk övervakning av lungfunktionen rekommenderas för patienter som behandlas med Exubera (se FÖRSIKTIGHETSÅTGÄRDER, Lungfunktion).
Exubera är avsett för administrering genom inandning och får endast administreras med Exubera® Inhalator. Referera till Exubera Läkemedelsguide för en beskrivning av Exubera® Inhalator och för instruktioner om hur du använder inhalatorn.
Beräkning av den inledande exuberadosen före måltid
Den initiala dosen av Exubera ska individualiseras och bestämmas utifrån läkarens råd i enlighet med patientens behov. Rekommenderade initiala doser före måltid baseras på kliniska prövningar där patienter uppmanades att äta tre måltider per dag. Initiala doser före måltid kan beräknas med följande formel: [Kroppsvikt (kg) X 0,05 mg / kg = dos före måltid (mg)] avrundas till närmaste hela milligramnummer (t.ex. 3,7 mg avrundat till 3 mg).
Ungefärliga riktlinjer för inledande Exubera-doser före måltid, baserat på patientens kroppsvikt, anges i tabell 7:
Tabell 7: Ungefärliga riktlinjer för initial exuberados före måltid (baserat på patientens kroppsvikt)
| Patientvikt (i kg) |
Patientvikt (i Ib) |
Inledande dos per måltid | Antal 1 mg blåsor per dos | Antal 3 mg blåsor per dos |
|---|---|---|---|---|
| 30 till 39,9 kg | 66 - 87 lb | 1 mg per måltid | 1 | - |
| 40 till 59,9 kg | 88 - 132 Ib | 2 mg per måltid | 2 | - |
| 60 till 79,9 kg | 133 - 176 pund | 3 mg per måltid | - | 1 |
| 80 till 99,9 kg | 177 - 220 pund | 4 mg per måltid | 1 | 1 |
| 100 till 119,9 kg | 221- 264 pund | 5 mg per måltid | 2 | 1 |
| 120 till 139,9 kg | 265 - 308 pund | 6 mg per måltid | - | 2 |
En blisterblåsning av Exubera inhalerat insulin motsvarar ungefär 3 IE subkutant injicerat vanligt humant insulin. En 3 mg blisterblåsning med Exubera inhalerat insulin motsvarar ungefär 8 IE subkutant injicerat vanligt humant insulin. Tabell 8 tillhandahåller ungefärlig IU-dos av regelbundet subkutant humant insulin för Exubera inhalerade insulindoser från 1 mg till 6 mg.
Tabell 8: Ungefärlig ekvivalent IU-dos av vanlig humant subkutan insulin för exubera inhalerade insulindoser från 1 mg till 6 mg
| Dos (mg) | Ungefärlig vanlig SC-dos i insulin i IU | Antal 1 mg Exubera-blåsor per dos | Antal 3 mg Exubera-blåsor per dos |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Patienterna bör kombinera 1 mg och 3 mg blåsor så att det minsta antalet blåsor per dos tas (t.ex. bör en 4 mg dos administreras som en 1 mg blister och en 3 mg blister). I följd inandning av tre 1 mg enhetsdosblister resulterar i signifikant större insulineksponering än inandning av en 3 mg enhetsdosblister. Därför bör tre doser på 1 mg inte ersättas med en dos på 3 mg (se KLINISK FARMAKOLOGIFarmakokinetik). När en patient stabiliseras på ett doseringssystem som innehåller 3 mg blåsor och 3 mg blåsor blir tillfälligt otillgänglig, kan patienten tillfälligt ersätta två 1 mg blåsor med en 3 mg blåsa. Blodglukos bör övervakas noggrant.
Som med alla insuliner inkluderar ytterligare faktorer som bör beaktas vid bestämning av utgångsdosen Exubera, men är inte begränsade till, patientens nuvarande glykemiska kontroll, tidigare svar på insulin, varaktighet av diabetes och kost och träning vanor.
Överväganden för dostitrering
Efter påbörjad Exubera-behandling, som med andra glukosesänkande medel, kan dosjustering krävas baserat på patientens behov (t.ex. blodglukoskoncentrationer, måltidsstorlek och näringssammansättning, tid på dygnet och nyligen eller förväntat övning). Varje patient ska titreras till sin optimala dosering baserat på blodsockerövervakningsresultat.
När det gäller alla insuliner kan tiden för Exubera-handlingen variera mellan olika individer eller vid olika tidpunkter hos samma individ.
Exubera kan användas under intercurrent respiratorisk sjukdom (t.ex. bronkit, övre luftvägsinfektion, rinit). En noggrann övervakning av blodglukoskoncentrationer och dosjustering kan krävas på individuell basis. Inhalerade läkemedel (t.ex. bronkodilatatorer) bör administreras före administrering av Exubera.
topp
Hur levereras
Exubera (humant insulin [rDNA-ursprung]) Inhalationspulver finns i 1 mg och 3 mg enhetsdosblister. Blåsorna fördelas på perforerade kort med sex enhetsdosblister (PVC / aluminium). De två styrkorna är differentierade med färgtryck och taktila märken som kan differentieras med beröring. Blåsorna på 1 mg och respektive perforerade kort är tryckta med grönt bläck och korten är markerade med en upphöjd stapel. 3 mg blister och respektive perforerade kort är tryckta med blått bläck och korten är markerade med tre upphöjda staplar.
Fem blisterkort är förpackade i ett klart plastformat bricka (PET). Varje PET-bricka innehåller också ett torkmedel och är täckt med ett klart plastlocket (PET). Facket med fem blisterkort (30 enhetsdosblåsor) förseglas i en folie-laminatpåse med ett torkmedel.
Exubera (humant insulin [rDNA-ursprung]) Inandning Pulverblåsor, en Exubera® Inhalator och utbyte Exubera® Släppningsenheter krävs för att initiera terapi med Exubera och finns i Exubera Kit. En färdigmonterad Exubera® Inhalatorn består av inhalatorbasen, en kammare och en Exubera® Släpp enheten. En helt monterad inhalator är förpackad med en utbyteskammare och finns i Exubera Kit och som en separat enhet. Kammaren finns också som en enskild komponent.
Exubera® Frigöringsenheter förpackas individuellt i ett förseglat termoformat bricka. En Exubera® Släppaggregat ingår i varje helt monterad inhalator. Två ytterligare frisläppsenheter finns i Exubera Kit och i varje kombinationspaket. Exubera frisläppsenheter finns också individuellt.
Se tabellerna 9 och 10 för en beskrivning av dessa konfigurationer.
Tabell 9
| Exubera (humant insulin [rDNA-ursprung]) Inhalationspulver finns som följer: | ||
|---|---|---|
| Beskrivning | Innehåll | NDC |
| Exubera KIT | 1 Exubera-inhalator 1 Ersättningsavdelning 1 mg - 180 blåsor 3 mg - 90 blåsor 2 Exubera® Släpp enheter |
0069-0050-85 |
| Exubera Combination Pack 12 | 1 mg - 90 blåsor 3 mg - 90 blåsor 2 Exubera® Släpp enheter |
0069-0050-19 |
| Exubera Combination Pack 15 | 1 mg - 180 blåsor 3 mg - 90 blåsor 2 Exubera® Släpp enheter |
0069-0050-53 |
| Exubera 1 mg Patient Pack | 90 × 1 mg 2 Exubera® Släpp enheter |
0069-0707-37 |
| Exubera 3 mg Patient Pack | 90 × 3 mg 2 Exubera® Släpp enheter |
0069-0724-37 |
Tabell 10
| Exubera® Inhalator och komponenter är tillgängliga enligt följande: | ||
|---|---|---|
| Beskrivning | Innehåll | NDC |
| Exubera® Inhalator och kammare | 1 Exubera® Inhalator 1 Ersättningsavdelning |
0069-0054-19 |
| Exubera® Släpp enheter | 2 Exubera® Släpp enheter | 0069-0097-41 |
| Exubera® Kammare | 1 Ersättningsavdelning | 0069-0061-19 |
Blisterförvaring
Ej i bruk (Oöppnad): Förvaras vid kontrollerad rumstemperatur, 25 ° C (77 ° F); utflykter tillåtna till 15-30 ° C (59-86 ° F) [se USP-kontrollerad rumstemperatur]. Frys inte. Kyl inte i kylen.
Vid användning: När folieöverdraget öppnas ska enhetsdosblister skyddas mot fukt, lagras vid 25 ° C (77 ° F). utflykter tillåtna till 15-30 ° C (59-86 ° F) [se USP-kontrollerad rumstemperatur]. Frys inte. Kyl inte i kylen. Enhetsdosblåsor ska användas inom tre månader efter att folieöverdraget öppnats. Sätt tillbaka blåsorna i omslaget för att skydda mot fukt. Ytterligare försiktighet bör vidtas för att undvika fuktiga miljöer, t.ex. ångande badrum efter dusch.
Kassera blåsan om den är fryst.
Inhalatorlagring
Förvara vid kontrollerad rumstemperatur, 25 ° C; utflykter tillåtna till 15-30 ° C (59-86 ° F) [se USP-kontrollerad rumstemperatur]. Frys inte. Kyl inte i kylen.
Exuberan® Inhalator kan användas i upp till 1 år från första dagen.
Byta ut Exubera® Släpp enheten
Exuberan® Släpp enheten i Exubera® Inhalator bör bytas varannan vecka.
Förvara utom räckhåll för barn
Endast Rx

LAB-0331-12,0
senaste revisionen 04/2008
Exubera, humant insulin [rDNA-ursprung] Patientinformation (på vanligt engelska)
Detaljerad information om tecken, symtom, orsaker, behandling av diabetes
Informationen i denna monografi är inte avsedd att täcka alla möjliga användningar, anvisningar, försiktighetsåtgärder, läkemedelsinteraktioner eller negativa effekter. Denna information är generaliserad och är inte avsedd som specifik medicinsk rådgivning. Om du har frågor om läkemedlen du tar eller vill ha mer information, kontakta din läkare, apotekspersonal eller sjuksköterska.
tillbaka till: Bläddra bland alla mediciner för diabetes



