Glyset för behandling av diabetes
Varumärke: Glyset
Generiskt namn: Miglitol
Innehåll:
Beskrivning
Klinisk farmakologi
Kliniska studier
Indikationer och användning
Kontra
försiktighetsåtgärder
Negativa reaktioner
överdosering
Dosering och administrering
Hur levereras
Glyset, miglitol, patientinformation (på vanligt engelska)
Beskrivning
GLYSET-tabletter innehåller miglitol, en oral alfa-glukosidas-hämmare för användning vid hantering av icke-insulinberoende diabetes mellitus (NIDDM). Miglitol är ett desoxynojirimycinderivat och är kemiskt känt som 3,4,5-piperidinetriol, 1- (2-hydroxietyl) -2- (hydroximetyl) -, [2R- (2Î ±, 3β, 4Î ±, 5β)] -. Det är ett vitt till blekgult pulver med en molekylvikt av 207,2. Miglitol är lösligt i vatten och har en pKa på 5,9. Dess empiriska formel är C8H17NO5 och dess kemiska struktur är enligt följande:

GLYSET finns som 25 mg, 50 mg och 100 mg tabletter för oral användning. De inaktiva ingredienserna är stärkelse, mikrokristallin cellulosa, magnesiumstearat, hypromellos, polyetylenglykol, titandioxid och polysorbat 80.
topp
Klinisk farmakologi
Miglitol är ett desoxynojirimycinderivat som försenar matsmältningen av intagna kolhydrater, vilket resulterar i en mindre ökning av blodsockerkoncentrationen efter måltiderna. Som en konsekvens av glukosreduktionen i plasma minskar GLYSET-tabletter halterna av glykosylerat hemoglobin hos patienter med typ II (icke-insulinberoende) diabetes mellitus. Systemisk icke-enzymatisk proteinglykosylering, vilket återspeglas av halter av glykosylerat hemoglobin, är en funktion av den genomsnittliga blodglukoskoncentrationen över tid.
Handlingsmekanism
Till skillnad från sulfonylurea förstärker GLYSET inte insulinsekretionen. Den antihyperglykemiska verkan av miglitol resulterar från en reversibel hämning av membranbundna tarm α ± -glukosidhydrolasenzymer. Membranbundna tarmar Î ± -glukosidaser hydrolyserar oligosackarider och disackarider till glukos och andra monosackarider i borstkanten på tunntarmen. Hos diabetespatienter resulterar denna enzymhämning i försenad glukosabsorption och sänkning av postprandial hyperglykemi.
Eftersom dess verkningsmekanism är annorlunda är effekten av GLYSET för att förbättra den glykemiska kontrollen tillsats till sulfonylurea när den används i kombination. Dessutom minskar GLYSET de insulinotropa och viktökande effekterna av sulfonylurea.
Miglitol har mindre hämmande aktivitet mot laktas och följaktligen skulle de rekommenderade doserna inte förväntas inducera laktosintolerans.
farmakokinetik
Absorption
Absorption av miglitol är mättbar vid höga doser: en dos på 25 mg absorberas fullständigt, medan en dos på 100 mg endast absorberas 50% - 70%. För alla doser uppnås toppkoncentrationer på 2-3 timmar. Det finns inga bevis för att systemisk absorption av miglitol bidrar till dess terapeutiska effekt.
Distribution
Proteinbindningen av miglitol är försumbar (<4,0%). Miglitol har en distributionsvolym på 0,18 L / kg, i överensstämmelse med fördelningen främst till den extracellulära vätskan.
Ämnesomsättning
Miglitol metaboliseras inte hos människor eller i någon undersökt djurart. Inga metaboliter har detekterats i plasma, urin eller avföring, vilket indikerar brist på systemisk eller pre-systemisk metabolism.
Exkretion
Miglitol elimineras genom renal utsöndring som oförändrat läkemedel. Efter en 25 mg-dos återvinns således över 95% av dosen i urinen inom 24 timmar. Vid högre doser är den kumulativa återvinningen av läkemedlet från urinen något lägre på grund av den ofullständiga biotillgängligheten. Eliminationshalveringstiden för miglitol från plasma är cirka 2 timmar.
Särskilda befolkningar
Nedsatt njurfunktion
Eftersom miglitol utsöndras främst av njurarna, förväntas ansamling av miglitol hos patienter med nedsatt njurfunktion. Patienter med kreatininclearance 60 ml / min. Dosjustering för att korrigera de ökade plasmakoncentrationerna är inte genomförbar eftersom miglitol verkar lokalt. Lite information finns om säkerheten för miglitol hos patienter med kreatininclearance <25 ml / min.
Nedsatt leverfunktion
Farmakokinetiken för Miglitol förändrades inte hos cirrhotiska patienter relativt friska kontrollpersoner. Eftersom miglitol inte metaboliseras förväntas ingen påverkan av leverfunktionen på kinetiken hos miglitol.
Kön
Ingen signifikant skillnad i farmakokinetiken för miglitol observerades mellan äldre män och kvinnor när kroppsvikt beaktades.
Lopp
Flera farmakokinetiska studier genomfördes på japanska frivilliga, med resultat liknande de som observerades hos kaukasier. En studie som jämförde det farmakodynamiska svaret på en enstaka 50 mg dos hos svarta och kaukasiska friska frivilliga indikerade liknande glukos- och insulinsvar i båda populationerna.
topp
Kliniska studier
Klinisk erfarenhet av icke-insulinberoende diabetes mellitus (NIDDM) patienter endast på dietbehandling
GLYSET-tabletter utvärderades i två amerikanska och tre icke-U.S.-kontrollerade, fixerade doser, monoterapistudier, i vilka 735 patienter behandlade med GLYSET utvärderades för effektivitetsanalyser (se tabell 1).
I studie 1, en ettårsstudie där GLYSET utvärderades som monoterapi och även som kombinationsterapi, fanns det en statistisk betydligt mindre ökning av genomsnittligt glykosylerat hemoglobin (HbA1c) över tid i miglitol 50 mg 3 gånger dagligen monoterapi till placebo. Signifikanta reduktioner i genomsnittliga fasta och postprandiala glukosnivåer i plasma och i genomsnittliga postprandiala insulinnivåer observerades hos patienter som behandlades med GLYSET jämfört med placebogruppen.
I studie 2, en 14-veckors studie, fanns en signifikant minskning av HbA1c hos patienter som fick GLYSET 50 mg 3 gånger dagligen eller 100 mg 3 gånger dagligen jämfört med placebo. Dessutom var det signifikanta minskningar av glukos efter plasmaplasma och insulinnivåer efter prandial jämfört med placebo.
Studie 3 var en 6-månaders dosintervallstudie som utvärderade GLYSET i doser från 25 mg 3 gånger dagligen till 200 mg 3 gånger dagligen. GLYSET producerade en större minskning av HbA1c än placebo vid alla doser, även om effekten endast var statistiskt signifikant vid 100 mg 3 gånger dagligen och 200 mg 3 gånger dagliga doser. Dessutom producerade alla doser av GLYSET signifikanta minskningar av glukos efter plandial plasmaglukos och insulin efter jämfört med placebo.
Studier 4 och 5 var 6-månadersstudier som utvärderade GLYSET vid 50 respektive 100 mg 3 gånger dagligen respektive 100 mg 3 gånger dagligen. Jämfört med placebo producerade GLYSET signifikanta reduktioner i HbA1c, såväl som en signifikant reduktion av glukos efter prandial plasma i båda studierna i de doser som användes.
Tabell 1 Resultat från monoterapistudie med Glyset
| Studie | Behandling | HbA1c (%) | 1 timmars postprandial glukos (mg / dL) | |
| Genomsnittlig förändring från baslinjen * | Behandlingseffekt ** | Genomsnittlig förändring från baslinjen | Behandlingseffekt ** | |
| 1 (U.S.) | Placebo | +0.71 | +24 | |
| GLYSET 50 mg t.i.d. *** | +0.13 | -0.58†| -39 | -63†|
| 2 (U.S.) | Placebo | +0.47 | +15 | |
| GLYSET 50 mg t.i.d. | -0.22 | -0.69†| -52 | -67†|
| GLYSET 100 mg t.i.d. | -0.28 | -0.75†| -59 | -74†|
| 3 (icke-USA) | Placebo | +0.18 | +2 | |
| GLYSET 25 mg t.i.d. | -0.08 | -0.26 | -33 | -35†|
| GLYSET 50 mg t.i.d. | -0.22 | -0.40 | -45 | -47†|
| GLYSET 100 mg t.i.d. | -0.63 | -0.81†| -62 | -64†|
| GLYSET 200 mg t.i.d.c | -0.84 | -1.02†| -85 | -87†|
| 4 (icke-USA) | Placebo | +0.01 | +8 | |
| GLYSET 50 mg t.i.d. | -0.35 | -0.36†| -20 | -28†|
| GLYSET 100 mg t.i.d. | -0.57 | -0.58†| -25 | -33†|
| 5 (icke-USA) | Placebo | +0.32 | +17 | |
| GLYSET 100 mg t.i.d. | -0.43 | -0.75†| -38 | -55†|
| * Genomsnittlig baslinje varierade från 7,54 till 8,72% i dessa studier. ** Resultatet av att subtrahera placebo-gruppgenomsnittet. *** t.i.d. = 3 gånger dagligen †p â ‰ ¤ 0,05 c Även om resultaten för 200 mg 3 gånger dagligen presenteras för fullständighet är den maximala rekommenderade dosen av GLYSET 100 mg 3 gånger dagligen. |
Klinisk erfarenhet av NIDDM-patienter som får sulfonylurea
GLYSET studerades som tilläggsbehandling mot en bakgrund av maximal eller nästan maximal sulfonylurea (SFU) -behandling i tre stora, dubbelblinda, slumpmässiga studier (två amerikanska och en icke-amerikansk) där 471 patienter behandlade med GLYSET utvärderades med avseende på effekt (ser Tabell 2).
Studie 6 inkluderade patienter under behandling med maximala doser av SFU vid inträde. I slutet av denna 14-veckors studie var de genomsnittliga behandlingseffekterna på glykosylerat hemoglobin (HbA1c) -0,82% och -0,74% för patienter som får GLYSET 50 mg 3 gånger dagligen plus SFU, och GLYSET 100 mg 3 gånger dagligen plus SFU, respektive.
Studie 7 var en ettårsstudie där GLYSET vid 25, 50 eller 100 mg 3 gånger dagligen sattes till en maximal dos glyburid (10 mg två gånger dagligen). I slutet av denna studie har de genomsnittliga behandlingseffekterna på HbA1c hos GLYSET vid tillsats till maximal glyburid terapi var -0,30%, -0,62% och -0,73% med 25, 50 och 100 mg 3 gånger dagliga doser av GLYSET, respektive.
I studie 8 gav tillsatsen av GLYSET 100 mg 3 gånger dagligen till en bakgrund av behandling med glyburid en ytterligare medelbehandlingseffekt på HbA1c på -0,66%.
Tabell 2: Resultat av kombinationsterapi med GLYSET Plus Sulfonylurea (SFU)
| Studie | Behandling | HbA1c (%) | 1 timmars postprandial glukos (mg / dL) | |
| Genomsnittlig förändring från baslinjen * | Behandlingseffekt ** | Genomsnittlig förändring från baslinjen | Behandlingseffekt ** | |
| 6 (U.S.) | Placebo + SFU | +0.33 | -1 | |
| GLYSET 50 mg t.i.d. *** + SFU | -0.49 | -0.82†| -69 | -68†|
| GLYSET 100 mg t.i.d. + SFU | -0.41 | -0.74†| -73 | -72†|
| 7 (U.S.) | Placebo + SFU | +1.01 | 48 | |
| GLYSET 25 mg t.i.d. + SFU | +0.71 | -0.30 | -2 | -50†|
| GLYSET 50 mg t.i.d. + SFU | +0.39 | -0.62†| -13 | -61†|
| GLYSET 100 mg t.i.d. + SFU | +0.28 | -0.73†| -33 | -81†|
| 8 (icke-USA) | Placebo + SFU | +0.16 | +10 | |
| GLYSET 100 mg t.i.d. + SFU | -0.50 | -0.66†| -36 | -46†|
| * Genomsnittlig baslinje varierade från 8,56 till 9,16% i dessa studier. ** Resultatet av att subtrahera placebo-gruppgenomsnittet. *** t.i.d. = 3 gånger dagligen â € p â ‰ 0,05 |
Dos-svars
Resultat från kontrollerade fasta dosstudier av Glyset som monoterapi eller som kombinationsbehandling med en sulfonylurea kombinerades för att erhålla en sammanlagd uppskattning av skillnaden från placebo i den genomsnittliga förändringen från baslinjen i glykosylerat hemoglobin (HbA1c) och postprandial plasmaglukos som visas i figur 1 och 2:
Figur 1: HbA1c (%) Genomsnittlig förändring från baslinjen: Behandlingseffekt Samlade resultat från kontrollerade fasta dosstudier i tabellerna 1 och 2

Figur 2: 1-timmars postprandial glukosplasma medelförändring från baslinjen: Behandlingseffekt Poolade resultat från kontrollerade fasta dosstudier i tabellerna 1 och 2
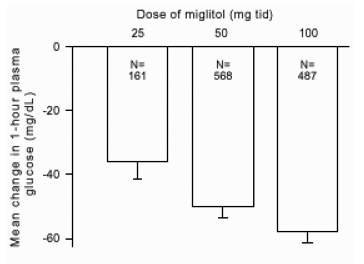
På grund av dess verkningsmekanism manifesteras den primära farmakologiska effekten av miglitol som en minskning av postprandial plasmaglukos, såsom tidigare visats i alla de stora kliniska studierna. GLYSET skilde sig statistiskt signifikant från placebo vid alla doser i var och en av de enskilda studierna med avseende på effekt i genomsnitt en timmes postprandial plasmaglukos, och det finns ett dosrespons från 25 till 100 mg 3 gånger dagligen för denna effekt parameter.
topp
Indikationer och användning
Glyset-tabletter, som monoterapi, indikeras som ett tillägg till kosten för att förbättra glykemisk kontroll i patienter med icke-insulinberoende diabetes mellitus (NIDDM) vars hyperglykemi inte kan hanteras med diet ensam. Glyset kan också användas i kombination med en sulfonylurea när diet plus antingen Glyset eller en sulfonylurea enbart inte resulterar i adekvat glykemisk kontroll. Effekten av Glyset för att förbättra den glykemiska kontrollen är tillsats till sulfonylurea när den används i kombination, antagligen på grund av att dess verkningsmekanism är annorlunda.
Vid inledande av behandling för NIDDM bör diet betonas som den primära behandlingsformen. Kaloribegränsning och viktminskning är viktigt hos den överviktiga diabetespatienten. Korrekt diethantering enbart kan vara effektivt för att kontrollera blodsocker och symtom på hyperglykemi. Betydelsen av regelbunden fysisk aktivitet när det är lämpligt bör också betonas. Om detta behandlingsprogram inte resulterar i adekvat glykemisk kontroll bör användningen av Glyset övervägas. Användningen av Glyset måste ses av både läkaren och patienten som en behandling utöver diet och inte som ett ersättare för diet eller som en bekväm mekanism för att undvika kostbegränsning.
topp
Kontra
GLYSET-tabletter är kontraindicerade hos patienter med:
- Diabetisk ketoacidos
- Inflammatorisk tarmsjukdom, colonic ulceration, eller partiell tarmhinder, och hos patienter som är disponerade för tarmobstruktion
- Kroniska tarmsjukdomar förknippade med markanta störningar i matsmältningen eller absorptionen, eller med tillstånd som kan försämras till följd av ökad gasbildning i tarmen
- Överkänslighet mot läkemedlet eller någon av dess komponenter.
topp
försiktighetsåtgärder
Allmän
hypoglykemi
På grund av dess verkningsmekanism bör GLYSET, om det administreras ensamt, inte orsaka hypoglykemi i fastande eller postprandialt tillstånd. Sulfonylurea-medel kan orsaka hypoglykemi. Eftersom GLYSET-tabletter som ges i kombination med en sulfonylurea kommer att orsaka en ytterligare sänkning av blodsockret, det kan öka den hypoglykemiska potentialen hos sulfonylurea, även om detta inte observerades i kliniskt prövningar. Oral glukos (dextros), vars absorption inte försenas av GLYSET, bör användas istället för sackaros (rørsocker) vid behandling av mild till måttlig hypoglykemi. Sackaros, vars hydrolys till glukos och fruktos hämmas av GLYSET, är olämplig för snabb korrigering av hypoglykemi. Svår hypoglykemi kan kräva användning av antingen intravenös glukosinfusion eller glukagoninjektion.
Förlust av kontroll av blodglukos
När diabetespatienter utsätts för stress som feber, trauma, infektion eller operation, kan en tillfällig förlust av kontrollen av blodsockret uppstå. Vid sådana tillfällen kan tillfällig insulinbehandling vara nödvändig.
Nedsatt njurfunktion
Plasmakoncentrationer av GLYSET hos nedsatt nedsatt volontär ökade proportionellt relativt graden av nedsatt njurfunktion. Långvariga kliniska prövningar på diabetespatienter med signifikant njurfunktion (serumkreatinin> 2,0 mg / dL) har inte genomförts. Därför rekommenderas inte behandling av dessa patienter med GLYSET.
Information för patienter
Följande information ska ges till patienter:
- Glyset ska tas oralt tre gånger om dagen i början (med den första biten) av varje huvudmåltid. Det är viktigt att fortsätta följa dietanvisningarna, ett regelbundet träningsprogram och regelbundna tester av urin och / eller blodsocker.
- Glyset i sig orsakar inte hypoglykemi även när det ges till patienter i fastande tillstånd. Sulfonylurea-läkemedel och insulin kan dock sänka blodsockernivåerna tillräckligt för att orsaka symtom eller ibland livshotande hypoglykemi. Eftersom Glyset ges i kombination med en sulfonylurea eller insulin kan orsaka en ytterligare sänkning av blodsockret, kan det öka hypoglykemiska potentialen hos dessa medel. Risken för hypoglykemi, dess symtom och behandling och tillstånd som predisponerar för dess utveckling bör förstås väl av patienter och ansvariga familjemedlemmar. Eftersom Glyset förhindrar nedbrytningen av bordsocker, bör en källa till glukos (dextros, D-glukos) vara lätt tillgängligt för att behandla symtom på lågt blodsocker när du tar Glyset i kombination med en sulfonylurea eller insulin.
- Om biverkningar uppstår med Glyset utvecklas de vanligtvis under de första veckorna av terapin. De är vanligtvis milda till måttliga dosrelaterade gastrointestinala effekter, såsom flatulens, mjuka avföring, diarré eller obehag i buken, och de minskar i allmänhet i frekvens och intensitet med tid. Avbrott av läkemedlet resulterar vanligtvis i snabb upplösning av dessa gastrointestinala symtom.
Laboratorietester
Terapeutiskt svar på GLYSET kan övervakas genom periodiska blodsockertest. Mätning av glykosylerat hemoglobinnivåer rekommenderas för övervakning av långsiktig glykemisk kontroll.
Hos 12 friska män påverkade inte samtidig antacida antacida farmakokinetiken för miglitol.
Läkemedelsinteraktioner
Flera studier undersökte den möjliga interaktionen mellan miglitol och glyburid. Hos sex friska frivilliga som fick en enda dos 5 mg glyburid på bakgrund av 6 dagars behandling med miglitol (50 mg 3 gånger dagligen i 4 dagar följt av 100 mg 3 gånger dagligen under 2 dagar) eller placebo, medelvärdet Cmax och AUC-värden för glyburid var 17% respektive 25% lägre när glyburid gavs med miglitol. I en studie på diabetespatienter där effekterna av att tillsätta miglitol 100 mg 3 gånger dagligen â 7 dagar eller placebo till en bakgrundsregim på 3,5 mg glyburid dagligen undersöktes, det genomsnittliga AUC-värdet för glyburid var 18% lägre i gruppen behandlad med miglitol, även om denna skillnad inte var statistiskt signifikant. Ytterligare information om en potentiell interaktion med glyburid erhölls från en av de stora amerikanska kliniska studierna (Studie 7) där patienter doserades antingen miglitol eller placebo på en bakgrund av 10 mg glyburid två gånger dagligen. Vid 6-månaders- och 1-års klinikbesök uppvisade patienter som tog samtidig miglitol 100 mg 3 gånger dagligen medelvärde Cmax värden för glyburid som var 16% respektive 8% lägre jämfört med patienter som tog glyburid ensam. Dessa skillnader var emellertid inte statistiskt signifikanta. Även om det fanns en trend mot lägre AUC och Cmax värden för glyburid vid samtidig administrering med Glyset, inget definitivt uttalande angående en potentiell interaktion kan göras baserat på de föregående tre studierna.
Effekten av miglitol (100 mg 3 gånger dagligen â 7 dagar) på farmakokinetiken för en enstaka dos på 1000 mg metformin undersöktes hos friska frivilliga. Medel AUC och Cmax värden för metformin var 12% till 13% lägre när de frivilliga fick miglitol jämfört med placebo, men denna skillnad var inte statistiskt signifikant.
I en hälsosam volontärstudie, samadministrering av antingen 50 mg eller 100 mg miglitol 3 gånger dagligen tillsammans med digoxin minskade de genomsnittliga plasmakoncentrationerna av digoxin med 19% och 28%, respektive. Hos diabetespatienter under behandling med digoxin ändrades dock inte plasmakoncentrationen av digoxin genom samtidig administrering av miglitol 100 mg 3 gånger dagligen - 14 dagar.
Andra friska frivillighetsstudier har visat att miglitol signifikant kan minska biotillgängligheten för ranitidin och propranolol med 60% respektive 40%. Ingen effekt av miglitol observerades på farmakokinetiken eller farmakodynamiken för varken warfarin eller nifedipin.
Intestinala adsorbenter (t.ex. kol) och matsmältningsenzympreparat innehållande kolhydratdelande enzymer (t.ex. amylas, pankreatin) kan minska effekten av Glyset och borde inte tas samtidigt.
Hos 12 friska män påverkade inte samtidig antacida antacida farmakokinetiken för miglitol.
Karcinogenes, mutagenes och nedsatt fertilitet
Miglitol administrerades till möss via dietvägen i doser så höga som cirka 500 mg / kg kroppsvikt (motsvarande mer än 5 gånger exponeringen hos människor baserat på AUC) för 21 månader. I en tvåårig råttstudie administrerades miglitol i kosten vid exponeringar som var jämförbara med de maximala exponeringarna från människa baserat på AUC. Det fanns inga bevis på cancerframkallande effekter till följd av dietbehandling med miglitol.
In vitro visade sig miglitol vara icke-mutagen i bakterienmutagenesanalysen (Ames) och den eukaryota framåtmutationsanalysen (CHO / HGPRT). Miglitol hade inga klastogena effekter in vivo i mikronukleustestet från mus. Det påvisades inga ärftliga mutationer vid dominerande dödlig analys.
En kombinerad fertilitetsstudie av män och kvinnor utförd på Wistar-råttor behandlade oralt med miglitol i dosnivåer av 300 mg / kg kroppsvikt (ungefär åtta gånger den maximala exponeringen för människan baserat på kroppens ytarea) gav ingen olämplig effekt på reproduktionsprestanda eller förmåga att reproducera. Dessutom kompromissades inte överlevnad, tillväxt, utveckling och fertilitet hos avkommorna.
Graviditet
Teratogena effekter
Graviditet kategori B
Säkerheten för GLYSET hos gravida kvinnor har inte fastställts. Utvecklingstoxikologiska studier har utförts på råttor i doser av 50, 150 och 450 mg / kg, motsvarande till nivåer av cirka 1,5, 4 och 12 gånger den maximala rekommenderade människors exponering baserat på kroppsytan område. Hos kaniner undersöktes doser av 10, 45 och 200 mg / kg motsvarande nivåer av ungefär 0,5, 3 och 10 gånger den humana exponeringen. Dessa studier avslöjade inga bevis på fosterbildningar som kan hänföras till miglitol. Doser av miglitol upp till 4 och 3 gånger den humana dosen (baserat på kroppsytan) för råttor respektive kaniner avslöjade inte bevis på nedsatt fertilitet eller skada på fostret. De högsta doserna som testades i dessa studier, 450 mg / kg hos råtta och 200 mg / kg hos kanin främjade maternal och / eller fostertoxicitet. Fetotoxicitet indikerades av en liten men signifikant minskning av fostrets vikt i råttstudien och en liten minskning i fostrets vikt, försenad ossificering av fostret och ökning av andelen icke-livskraftiga foster i kanin studie. I den peri-postnatala studien på råttor var NOAEL (ingen observerad negativ effektnivå) 100 mg / kg (motsvarande ungefär fyra gånger exponeringen för människor, baserat på kroppsytan). En ökning av dødfödda avkommor noterades vid den höga dosen (300 mg / kg) i råttan per-postnatal studie, men inte vid den höga dosen (450 mg / kg) i leveranssegmentet för råttens utvecklingstoxicitet studie. Annars var det ingen negativ effekt på överlevnad, tillväxt, utveckling, beteende eller fertilitet i varken råttens utvecklingstoxicitet eller peri-postnatal studier. Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom djurreproduktionsstudier inte alltid förutsäger människors svar, bör detta läkemedel användas under graviditet om det är klart nödvändigt.
Ammande mödrar
Miglitol har visat sig utsöndras i bröstmjölk i mycket liten grad. Total utsöndring i mjölk stod för 0,02% av en 100 mg mammados. Den uppskattade exponeringen för ett ammande barn är ungefär 0,4% av moderdosen. Även om halterna av miglitol som uppnås i bröstmjölk är mycket låga rekommenderas att GLYSET inte administreras till en ammande kvinna.
Pediatrisk användning
Säkerhet och effektivitet hos GLYSET hos barn har inte fastställts.
Geriatrisk användning
Av det totala antalet personer i kliniska studier av GLYSET i USA inkluderade patienter giltiga för säkerhetsanalyser 24% över 65 och 3% över 75. Inga övergripande skillnader i säkerhet och effektivitet observerades mellan dessa individer och yngre personer. Farmakokinetiken för miglitol studerades hos äldre och unga män (n = 8 per grupp). Vid doseringen av 100 mg 3 gånger dagligen under 3 dagar hittades inga skillnader mellan de två grupperna.
topp
Negativa reaktioner
gastrointestinal
Gastrointestinala symtom är de vanligaste reaktionerna på GLYSET-tabletter. I amerikanska placebokontrollerade studier var förekomsten av buksmärta, diarré och flatulens 11,7%, 28,7% respektive 41,5% i 962 patienter behandlade med GLYSET 25-100 mg 3 gånger dagligen, medan motsvarande incidenter var 4,7%, 10,0% och 12,0% i 603 placebo-behandlade patienter. Förekomsten av diarré och buksmärta tenderade att minska avsevärt vid fortsatt behandling.
dermatologisk
Hudutslag rapporterades hos 4,3% av patienterna som behandlades med GLYSET jämfört med 2,4% av placebo-behandlade patienter. Utslag var vanligtvis övergående och de flesta bedömdes vara inte relaterade till GLYSET av läkare-utredare.
Onormala laboratoriefin
Järn med lågt serum förekom oftare hos patienter som behandlades med GLYSET (9,2%) än hos placebobehandlade patienter (4,2%) men gjorde inte kvarstår i majoriteten av fallen och var inte associerad med minskning av hemoglobin eller förändringar i andra hematologiska index.
topp
överdosering
Till skillnad från sulfonylurea eller insulin, kommer en överdos av GLYSET tabletter inte att leda till hypoglykemi. En överdos kan leda till kortvariga ökningar av flatulens, diarré och obehag i buken. På grund av avsaknaden av extra-intestinala effekter som observerats med GLYSET, förväntas inga allvarliga systemiska reaktioner vid överdosering.
topp
Dosering och administrering
Det finns ingen fast doseringsplan för hantering av diabetes mellitus med GLYSET-tabletter eller något annat farmakologiskt medel. Dosering av GLYSET måste individualiseras utifrån både effektivitet och tolerans samtidigt som den högsta rekommenderade dosen på 100 mg 3 gånger dagligen inte överskrids. GLYSET ska tas tre gånger dagligen vid starten (med den första biten) av varje huvudmåltid. GLYSET bör börja med 25 mg och doseringen ökas gradvis enligt beskrivningen nedan, båda för att minska gastrointestinala biverkningar och för att möjliggöra identifiering av den minimidos som krävs för adekvat glykemisk kontroll av patienten.
Under behandlingsstart och dostitrering (se nedan) kan en timmes postprandial plasmaglukos vara används för att bestämma det terapeutiska svaret på GLYSET och identifiera den minsta effektiva dosen för patient. Därefter bör glykosylerat hemoglobin mätas med intervaller på cirka tre månader. Det terapeutiska målet bör vara att minska både postprandial plasmaglukos och glykosylerat hemoglobinnivå till normalt eller nära det normala genom att använda den lägsta effektiva dosen av GLYSET, antingen som monoterapi eller i kombination med en sulfonylurea.
Inledande dosering
Den rekommenderade startdosen av GLYSET är 25 mg, ges oralt tre gånger dagligen vid starten (med den första biten) av varje huvudmåltid. Vissa patienter kan emellertid dra nytta av att börja med 25 mg en gång dagligen för att minimera biverkningar i mag-tarmkanalen och gradvis öka administreringsfrekvensen till 3 gånger dagligen.
Underhållsdosering
Den vanliga underhållsdosen av GLYSET är 50 mg 3 gånger dagligen, även om vissa patienter kan ha fördel av att öka dosen till 100 mg 3 gånger dagligen. För att möjliggöra anpassning till potentiella gastrointestinala biverkningar rekommenderas att GLYSET-terapi görs initierades i en dos av 25 mg 3 gånger dagligen, den lägsta effektiva dosen och titrerades sedan gradvis uppåt för att tillåta anpassning. Efter 4 - 8 veckor av den 25 mg 3 gånger dagliga behandlingen bör dosen ökas till 50 mg 3 gånger dagligen för ungefär tre månader, varefter en glykosylerad hemoglobinnivå bör mätas för att utvärdera terapeutiskt svar. Om den glykosylerade hemoglobinnivån vid den tidpunkten inte är tillfredsställande kan doseringen ytterligare höjas till 100 mg 3 gånger dagligen, den maximala rekommenderade dosen. Samlade data från kontrollerade studier tyder på ett dosrespons för både HbA1c och en timmes postprandial plasmaglukos i det rekommenderade dosområdet. Ingen enda studie har emellertid undersökt effekten på glykemisk kontroll av patienternas doser uppåt inom samma studie. Om ingen ytterligare minskning av postprandial glukos eller glykosylerat hemoglobinnivå observeras med titrering till 100 mg 3 gånger dagligen, bör hänsyn tas till att sänka dosen. När en effektiv och tolererad dosering har fastställts, bör den bibehållas.
Maximal dosering
Den maximala rekommenderade dosen av GLYSET är 100 mg 3 gånger dagligen. I en klinisk studie gav 200 mg 3 gånger dagligen ytterligare förbättrad glykemisk kontroll men ökade förekomsten av gastrointestinala symtom beskrivna ovan.
Patienter som får sulfonylurea
Sulfonylurea-medel kan orsaka hypoglykemi. Det var ingen ökad förekomst av hypoglykemi hos patienter som tog GLYSET i kombination med sulfonylurea medel jämfört med förekomsten av hypoglykemi hos patienter som endast fick sulfonylurea i alla kliniska rättegång.
GLYSET som ges i kombination med en sulfonylurea kommer emellertid att orsaka en ytterligare sänkning av blodglukos och kan öka risken för hypoglykemi på grund av tillsatseffekterna av de två medlen. Om hypoglykemi inträffar, bör lämpliga justeringar av doserna göras.
topp
Hur levereras
GLYSET-tabletter finns som 25 mg, 50 mg och 100 mg vita, runda, filmdragerade tabletter. Tabletterna är präglade med ordet "GLYSET" på ena sidan och styrkan på den andra sidan, såsom anges nedan.
| Styrka | NDC | Tablettidentifiering | |
| Främre | Tillbaka | ||
| Flaskor med 100: | |||
| 25 mg | 0009-5012-01 | GLYSET | 25 |
| 50 mg | 0009-5013-01 | GLYSET | 50 |
| 100 mg | 0009-5014-01 | GLYSET | 100 |
Förvara vid 25 ° C; utflykter tillåtna till 15 ° -30 ° C (59 ° -86 ° F) [se USP-kontrollerad rumstemperatur].
Endast Rx

Tillverkad av:
Bayer HealthCare AG
Leverkusen, Tyskland
Glyset är ett registrerat varumärke som tillhör Bayer HealthCare Pharmaceuticals Inc som används under licens.
LAB-0167-6,0
senast uppdaterad 05/2008
Glyset, miglitol, patientinformation (på vanligt engelska)
Detaljerad information om tecken, symtom, orsaker, behandling av diabetes
Informationen i denna monografi är inte avsedd att täcka alla möjliga användningar, anvisningar, försiktighetsåtgärder, läkemedelsinteraktioner eller negativa effekter. Denna information är generaliserad och är inte avsedd som specifik medicinsk rådgivning. Om du har frågor om läkemedlen du tar eller vill ha mer information, kontakta din läkare, apotekspersonal eller sjuksköterska.
tillbaka till: Bläddra bland alla mediciner för diabetes



