Prandin för behandling av diabetes
Varumärke: Prandin
Generiskt namn: repaglinide
Innehåll:
Beskrivning
Farmakologi
Indikationer och användning
Kontra
försiktighetsåtgärder
Negativa reaktioner
Överdos
Dosering
levereras
Prandin, patientinformation (på vanligt engelska)
Beskrivning
Prandin® (repaglinid) är ett oralt blodsockersänkande läkemedel i meglitinidklassen som används i hantering av typ 2-diabetes mellitus (även känd som icke-insulinberoende diabetes mellitus eller NIDDM). Repaglinid, S (+) 2-etoxi-4 (2 ((3-metyl-l- (2- (1-piperidinyl) fenyl) -butyl) amino) -2-oxoetyl) bensoesyra, är kemiskt inte relaterad till den orala sulfonylurea insulin secretagogues.
Strukturformeln är som visas nedan:
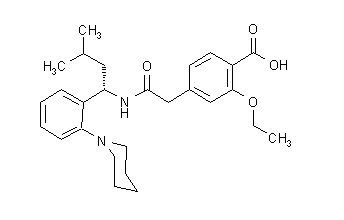
Repaglinid är ett vitt till benvitt pulver med molekylformel C27 H36 N204 och en molekylvikt av 452,6. Prandin-tabletter innehåller 0,5 mg, 1 mg eller 2 mg repaglinid. Dessutom innehåller varje tablett följande inaktiva ingredienser: kalciumvätefosfat (vattenfri), mikrokristallin cellulosa, majsstärkelse, polakrilinkalium, povidon, glycerol (85%), magnesiumstearat, meglumin, och poloxamer. Tabletterna på 1 mg och 2 mg innehåller järnoxider (gula respektive röda) som färgämnen.
topp
Klinisk farmakologi
Handlingsmekanism
Repaglinid sänker blodglukosnivån genom att stimulera frisättningen av insulin från bukspottkörteln. Denna åtgärd är beroende av fungerande beta-celler i bukspottkörtelöarna. Insulinfrisättning är glukosberoende och minskar vid låga glukoskoncentrationer.
Repaglinid stänger ATP-beroende kaliumkanaler i cell-cellmembranet genom bindning på karakteriserbara platser. Denna kaliumkanalblockad depolariserar Ÿ-cellen, vilket leder till en öppning av kalciumkanaler. Den resulterande ökade kalciuminflödet inducerar insulinutsöndring. Jonkanalmekanismen är mycket vävnadsselektiv med låg affinitet för hjärta och skelettmuskel.
farmakokinetik
Absorption:
Efter oral administrering absorberas repaglinid snabbt och fullständigt från mag-tarmkanalen. Efter enstaka och flera orala doser hos friska försökspersoner eller hos patienter förekommer maximala plasmaläkemedelsnivåer (Cmax) inom 1 timme (Tmax). Repaglinid elimineras snabbt från blodströmmen med en halveringstid på cirka 1 timme. Den genomsnittliga absoluta biotillgängligheten är 56%. När repaglinid gavs med mat förändrades inte medelvärdet av Tmax, men medelvärde Cmax och AUC (område under tid / plasmakoncentrationskurvan) minskade med 20% respektive 12,4%.
Distribution:
Efter intravenös dosering (IV) hos friska försökspersoner var distributionsvolymen vid steady state (Vss) 31 L och den totala kroppsklarheten (CL) var 38 L / h. Proteinbindning och bindning till humant serumalbumin var större än 98%.
Ämnesomsättning:
Repaglinid metaboliseras fullständigt genom oxidativ biotransformation och direkt konjugering med glukuronsyra efter antingen en IV eller oral dos. Huvudmetaboliterna är en oxiderad dikarboxylsyra (M2), den aromatiska aminen (M1) och acylglukuroniden (M7). Cytokrom P-450-enzymsystemet, specifikt 2C8 och 3A4, har visats vara involverat i N-dealkyleringen av repaglinid till M2 och vidare oxidation till M1. Metaboliter bidrar inte till den glukosesänkande effekten av repaglinid.
Exkretion:
Inom 96 timmar efter dosering med 14C-repaglinid som en enda oral dos, återfanns ungefär 90% av radiomärket i avföringen och cirka 8% i urinen. Endast 0,1% av dosen rensas i urinen som moderförening. Huvudmetaboliten (M2) stod för 60% av den administrerade dosen. Mindre än 2% av moderläkemedlet utvanns i avföring.
Farmakokinetiska parametrar:
De farmakokinetiska parametrarna för repaglinid erhållna från en engångsdos, crossover-studie hos friska försökspersoner och från en multipeldos, parallell, dosproportionalitet (0,5, 1, 2 och 4 mg) -studie hos patienter med typ 2-diabetes sammanfattas i följande tabell:
| Parameter | Patienter med typ 2-diabetes * |
|
Dos 0,5 mg 1 mg 2 mg 4 mg |
AUC0-24 timmar Medel ± SD (ng / ml * h): 68.9 ± 154.4 125.8 ± 129.8 152.4 ± 89.6 447.4 ± 211.3 |
|
Dos 0,5 mg 1 mg 2 mg 4 mg |
Cmax0-5 timmar Medel ± SD (ng / ml): 9.8 ± 10.2 18.3 ± 9.1 26.0 ± 13.0 65.8 ± 30.1 |
|
Dos 0,5 - 4 mg |
Tmax0-5 timmar Medel (SD) 1,0 - 1,4 (0,3 - 0,5) timmar |
|
Dos 0,5 - 4 mg |
T ½ Medel (Ind Range) 1,0 - 1,4 (0,4 - 8,0) timmar |
| Parameter | Friska ämnen |
| CL baserat på i.v. | 38 ± 16 l / h |
| Vss baserat på i.v. | 31 ± 12 L |
| AbsBio | 56 ± 9% |
|
CL = total kroppsfrihet Vss= distributionsvolym vid stabil tillstånd AbsBio = absolut biotillgänglighet |
* doseras i förväg med tre måltider
Dessa data indikerar att repaglinid inte ackumulerades i serum. Clearance av oral repaglinid förändrades inte inom dosområdet 0,5 - 4 mg, vilket indikerade ett linjärt samband mellan dos och plasmaläkemedelsnivåer.
Exponeringens variation:
Repaglinid AUC efter flera doser på 0,25 till 4 mg med varje måltid varierar över ett brett intervall. De intra-individuella respektive inter-individuella variationskoefficienterna var 36% respektive 69%. AUC över det terapeutiska dosområdet omfattade 69 till 1005 ng / ml * h, men AUC-exponering upp till 5417 ng / ml * timmar uppnåddes i dosökningsstudier utan uppenbara ogynnsamma konsekvenser.
Särskilda befolkningar:
Geriatrisk:
Friska frivilliga behandlades med en behandling på 2 mg taget före var och en av tre måltider. Det fanns inga signifikanta skillnader i farmakokinetiken för repaglinid mellan gruppen av patienter. FÖRSIKTIGHETER, Geriatrisk användning)
Pediatrisk:
Inga studier har utförts på barn.
Kön:
En jämförelse av farmakokinetiken hos män och kvinnor visade att AUC i dosområdet 0,5 mg till 4 mg var 15 till 70% högre hos kvinnor med typ 2-diabetes. Denna skillnad återspeglades inte i frekvensen av hypoglykemiska episoder (manlig: 16%; kvinna: 17%) eller andra biverkningar. När det gäller kön indikeras ingen förändring i den allmänna dosanbefalningen eftersom dosering för varje patient bör individualiseras för att uppnå optimal klinisk respons.
Lopp:
Inga farmakokinetiska studier för att bedöma effekterna av ras har genomförts, men i en amerikansk 1-årig studie på patienter med typ 2-diabetes, den blodsockersänkande effekten var jämförbar mellan kaukasier (n = 297) och afroamerikaner (n = 33). I en amerikansk dosresponsstudie fanns det ingen uppenbar skillnad i exponering (AUC) mellan kaukasier (n = 74) och Hispanics (n = 33).
Läkemedelsinteraktioner
Läkemedelsinteraktionsstudier utförda på friska frivilliga visar att Prandin inte hade någon kliniskt relevant effekt på de farmakokinetiska egenskaperna hos digoxin, teofyllin eller warfarin. Samtidig administration av cimetidin med Prandin förändrade inte signifikant absorptionen och depositionen av repaglinid.
Följande läkemedel studerades dessutom hos friska frivilliga med samtidig administrering av Prandin. Nedan listas resultaten:
Gemfibrozil och Itraconazole:
Samtidig administration av gemfibrozil (600 mg) och en engångsdos på 0,25 mg Prandin (efter 3 dagar med två gånger dagligen 600 mg gemfibrozil) resulterade i en 8,1 gånger högre repaglinid AUC och förlängd repaglinidhalveringstid från 1,3 till 3,7 timmar. Samtidig administrering med itraconazol och en enda dos av 0,25 mg Prandin (den tredje dagen av a behandling med 200 mg initialdos, 100 mg itraconazol två gånger dagligen) resulterade i 1,4 gånger högre repaglinid AUC. Samtidig administrering av både gemfibrozil och itraconazol med Prandin resulterade i 19 gånger högre repaglinid AUC och förlängd halveringstid för repaglinid till 6,1 timmar. Plasmagepaglinidkoncentration vid 7 timmar ökade 28,6-faldigt med gemfibrozil-samtidig administrering och 70,4-faldigt med gemfibrozil-itraconazol-kombinationen (se FÖRSIKTIGHETSÅTGÄRDER, Drug-Drug Interactions).
ketokonazol:
Samtidig administrering av 200 mg ketokonazol och en engångsdos på 2 mg Prandin (efter 4 dagar av en gång daglig ketokonazol 200 mg) resulterade i en 15% och 16% ökning av repaglinid AUC och Cmax, respektive. Ökningarna var från 20,2 ng / ml till 23,5 ng / ml för Cmax och från 38,9 ng / ml * timme till 44,9 ng / ml * timme för AUC.
rifampin:
Samtidig administration av 600 mg rifampin och en enstaka dos av 4 mg Prandin (efter 6 dagar med en gång dagligen rifampin 600 mg) resulterade i en 32% respektive 26% minskning av AUC respektive Cmax för repaglinid. Minskningarna var från 40,4 ng / ml till 29,7 ng / ml för Cmax och från 56,8 ng / ml * timme till 38,7 ng / ml * timme för AUC.
I en annan studie, samadministrering av 600 mg rifampin och en enda dos av 4 mg Prandin (efter 6 dagar av en gång dagligt rifampin 600 mg) resulterade i en 48% och 17% minskning av repaglinidmedian AUC och median Cmax respektive. Medianminskningarna var från 54 ng / ml * timme till 28 ng / ml * timme för AUC och från 35 ng / ml till 29 ng / ml för Cmax. Prandin administrerat av sig själv (efter 7 dagar med en gång dagligen rifampin 600 mg) resulterade i en 80% respektive 79% minskning av repaglinidmedian AUC respektive Cmax. Minskningarna var från 54 ng / ml * timme till 11 ng / ml * timme för AUC och från 35 ng / ml till 7,5 ng / ml för Cmax.
Levonorgestrel & Ethinyl Estradiol:
Samtidig administrering av en kombinationstablett av 0,15 mg levonorgestrel och 0,03 mg etinylöstradiol administrerad en gång dagligen under 21 dagar med 2 mg Prandin administreras tre gånger dagligen (dag 1-4) och en enda dos på dag 5 resulterade i 20% ökning av repaglinid, levonorgestrel och etinylöstradiol Cmax. Ökningen i repaglinid Cmax var från 40,5 ng / ml till 47,4 ng / ml. Ethinylöstradiol AUC-parametrar ökades med 20%, medan repaglinid- och levonorgestrel AUC-värden förblev oförändrade.
simvastatin:
Samtidig administrering av 20 mg simvastatin och en enda dos av 2 mg Prandin (efter 4 dagar av simvastatin 20 en gång dagligen) mg och tre gånger dagligen Prandin 2 mg) resulterade i en 26% ökning av repaglinid Cmax från 23,6 ng / ml till 29,7 ng / ml. AUC var oförändrad.
Nifedipine:
Samtidig administrering av 10 mg nifedipin med en enda dos av 2 mg Prandin (efter 4 dagar av tre gånger dagligen nifedipin 10 mg och tre gånger dagligen Prandin 2 mg) resulterade i oförändrade AUC- och Cmax-värden för båda läkemedel.
klaritromycin:
Samtidig administrering av 250 mg klaritromycin och en enstaka dos på 0,25 mg Prandin (efter 4 dagar på två gånger) dagligt klaritromycin 250 mg) resulterade i en 40% och 67% ökning av repaglinid AUC och Cmax, respektive. Ökningen i AUC var från 5,3 ng / ml * timme till 7,5 ng / ml * timme och ökningen i Cmax var från 4,4 ng / ml till 7,3 ng / ml.
trimetoprim:
Samtidig administration av 160 mg trimetoprim och en enda dos av 0,25 mg Prandin (efter 2 dagar två gånger dagligen och en dos den tredje dagen av trimetoprim 160 mg) resulterade i en 61% och 41% ökning av repaglinid AUC och Cmax, respektive. Ökningen i AUC var från 5,9 ng / ml * timme till 9,6 ng / ml * timme och ökningen i Cmax var från 4,7 ng / ml till 6,6 ng / ml.
Nedsatt njurfunktion
Enkeldos- och steady-state farmakokinetik för repaglinid jämfördes mellan patienter med typ 2-diabetes och normal njurfunktion (CrCl> 80 ml / min), mild till måttlig nedsatt njurfunktion (CrCl = 40 - 80 ml / min) och allvarlig nedsatt njurfunktion (CrCl = 20 - 40 ml / min). Både AUC och Cmax för repaglinid var liknande hos patienter med normal och mild till måttligt nedsatt njurfunktion (medelvärden 56,7 ng / ml * h vs 57,2 ng / ml * h respektive 37,5 ng / ml vs 37,7 ng / ml.) Patienter med svårt nedsatt njurfunktion hade förhöjd genomsnittlig AUC och Cmax värden (98,0 ng / ml * h respektive 50,7 ng / ml), men denna studie visade endast en svag korrelation mellan repaglinidnivåer och kreatinin undanröjning. Inledande dosjustering verkar inte vara nödvändig för patienter med mild till måttlig nedsatt njurfunktion. Patienter med typ 2-diabetes som har allvarlig nedsatt njurfunktion bör emellertid inleda behandling med Prandin med 0,5 mg-dosen. Därefter bör patienterna titreras noggrant. Studier utfördes inte på patienter med kreatininclearance under 20 ml / min eller patienter med njurfel som krävde hemodialys.
Nedsatt leverfunktion
En enkeldos, öppen etikettstudie utfördes på 12 friska försökspersoner och 12 patienter med kronisk leversjukdom (CLD) klassificerad enligt Child-Pugh-skala och koffein-clearance. Patienter med måttligt till allvarligt nedsatt leverfunktion hade högre och mer långvariga serumkoncentrationer av både total och obundet repaglinid än friska personer (AUChealthy: 91,6 ng / ml * timme; AUCCLD-patienter: 368,9 ng / ml * timme; Cmax, frisk: 46,7 ng / ml; Cmax, CLD-patienter: 105,4 ng / ml). AUC korrelerades statistiskt med koffein-clearance. Ingen skillnad i glukosprofiler observerades mellan patientgrupper. Patienter med nedsatt leverfunktion kan utsättas för högre koncentrationer av repaglinid och dess associerade metaboliter än patienter med normal leverfunktion som får vanliga doser. Därför bör Prandin användas försiktigt hos patienter med nedsatt leverfunktion. Längre intervaller mellan dosjusteringar bör användas för att möjliggöra en fullständig bedömning av responsen.
Kliniska tester
Monoterapiförsök
En fyra veckors, dubbelblind, placebokontrollerad dosresponsstudie genomfördes hos 138 patienter med typ 2-diabetes med doser från 0,25 till 4 mg tagna med var och en av tre måltider. Prandinbehandling resulterade i dosproportionell glukossänkning över hela dosområdet. Insulinnivåerna i plasma ökade efter måltiderna och återgått till baslinjen före nästa måltid. Det mesta av den fastande blodsockersänkande effekten påvisades inom 1-2 veckor.
I en dubbelblind, placebokontrollerad, 3-månaders dostitreringsstudie, var Prandin eller placebodoser för varje patient ökade varje vecka från 0,25 mg till 0,5, 1 och 2 mg, till maximalt 4 mg, tills en fastande plasmaglukos (FPG) nivå
Prandin vs. Placebo-behandling: Genomsnittlig FPG, PPG och HbA1c Förändringar från baslinjen efter 3 månaders behandling:
| ||||||
| FPG (mg / dL) | PPG (mg / dL) | HbA1c (%) | ||||
| PL | R | PL | R | PL | R | |
| Baseline | 215.3 | 220.2 | 245.2 | 261.7 | 8.1 | 8.5 |
|
Ändra från baslinjen (vid sista besök) |
30.3 | -31.0* | 56.5 | -47.6* |
1.1 | -0.6* |
|
FPG = fastande plasmaglukos PPG = glukos efter prandial PL = placebo (N = 33) R = repaglinid (N = 66) |
En annan dubbelblind, placebokontrollerad studie genomfördes på 362 patienter som behandlades under 24 veckor. Effekten av preprandiala doser på 1 och 4 mg visades genom sänkning av fastande blodglukos och med HbA1c i slutet av studien. HbA1c för de Prandin-behandlade grupperna (1 och 4 mg grupper tillsammans) i slutet av studien minskades jämfört med placebo-behandlade grupp i tidigare tidigare patienter och patienter som tidigare behandlats med orala hypoglykemiska medel med 2,1% enheter och 1,7% enheter, respektive. I denna fastdosstudie var patienter som inte var orala med hypoglykemisk behandling och patienter relativt relativt bra glykemisk kontroll vid baslinjen (HbA1c under 8%) visade större blodsockersänkande inklusive en högre frekvens av hypoglykemi. Patienter som tidigare behandlats och som hade baslinjen HbA1c - 8% rapporterade hypoglykemi i samma takt som patienter randomiserade till placebo. Det var ingen genomsnittlig ökning av kroppsvikt när patienter som tidigare behandlats med orala hypoglykemiska medel byttes till Prandin. Den genomsnittliga viktökningen hos patienter som behandlades med Prandin och som inte tidigare behandlats med sulfonylurea-läkemedel var 3,3%.
Dosen av Prandin relativt måltidsrelaterad insulinfrisättning studerades i tre studier inklusive 58 patienter. Glykemisk kontroll bibehölls under en period där måltiden och doseringsmönstret varierades (2, 3 eller 4 måltider per dag; före måltider x 2, 3 eller 4) jämfört med en period på 3 vanliga måltider och 3 doser per dag (före måltider x 3). Det visades också att Prandin kan administreras i början av en måltid, 15 minuter före eller 30 minuter före måltiden med samma blodsockersänkande effekt.
Prandin jämfördes med andra insulinsekretagoger i 1-års kontrollerade studier för att visa jämförbarhet mellan effekt och säkerhet. Hypoglykemi rapporterades hos 16% av 1228 Prandin-patienter, 20% av 417 glyburidpatienter och 19% av 81 glipizidpatienter. Av Prandin-behandlade patienter med symptomatisk hypoglykemi utvecklade ingen koma eller krävde sjukhusvistelse.
Kombinationsförsök
Prandin studerades i kombination med metformin hos 83 patienter som inte tillfredsställande kontrollerades på träning, diet och metformin enbart. Prandindosen titrerades i 4 till 8 veckor följt av en underhållsperiod på 3 månader. Kombinationsterapi med Prandin och metformin resulterade i signifikant större förbättring av glykemisk kontroll jämfört med monagoterapi med repaglinid eller metformin. HbA1c förbättrades med 1% enhet och FPG minskade med ytterligare 35 mg / dL. I denna studie där metformindosen hölls konstant, visade kombinationsterapin av Prandin och metformin dosbesparande effekter med avseende på Prandin. Kombinationsgruppens större effektrespons uppnåddes vid en lägre daglig dos av repaglinid än i monoterapigruppen Prandin (se tabell).
Prandin- och metforminterapi: Medelförändringar från baslinjen i glykemiska parametrar och vikt efter 4 till 5 månaders behandling *
| Prandin | Kombination | metformin | |
| N | 28 | 27 | 27 |
|
Median slutdos (Mg / dag) |
12 |
6 (Prandin) 1500 (metformin) |
1500 |
| HbA1c (% enheter) | -0.38 | -1.41** | -0.33 |
| FPG (mg / dL) | 8.8 | -39.2** | -4.5 |
| vikt (kg) | 3.0 | 2.4*** | -0.90 |
* baserat på avsikt att behandla analys
** p <0,05, för parvisa jämförelser med Prandin och metformin.
*** p <0,05, för parvis jämförelse med metformin.
Ett kombinationsbehandlingsschema av Prandin och pioglitazon jämfördes med monoterapi med endera medlet enbart i en 24-veckorsstudie som inkluderade 246 patienter som tidigare behandlats med sulfonylurea eller metformin monoterapi (HbA1c> 7.0%). Antal behandlade patienter var: Prandin (N = 61), pioglitazon (N = 62), kombination (N = 123). Prandindosen titrerades under de första 12 veckorna, följt av en underhållsperiod på 12 veckor. Kombinationsterapi resulterade i signifikant större förbättring av glykemisk kontroll jämfört med monoterapi (figur nedan). Förändringarna från baslinjen för kompletteringar i FPG (mg / dL) respektive HbA1c (%) var: -39,8 och -0,1 för Prandin, -35,3 och -0,1 för pioglitazon och -92,4 och -1,9 för kombinationen. I denna studie där pioglitazondoseringen hölls konstant, visade kombinationsbehandlingsgruppen dosbesparande effekter med avseende på Prandin (se figurlegenden). Det högre effektivitetsresponset i kombinationsgruppen uppnåddes vid en lägre daglig dos av repaglinid än i monoterapigruppen Prandin. Medelviktökningar förenade med kombination, Prandin och pioglitazonbehandling var 5,5 kg, 0,3 kg respektive 2,0 kg.
HbA1c Värden från Prandin / Pioglitazon-kombinationstudie
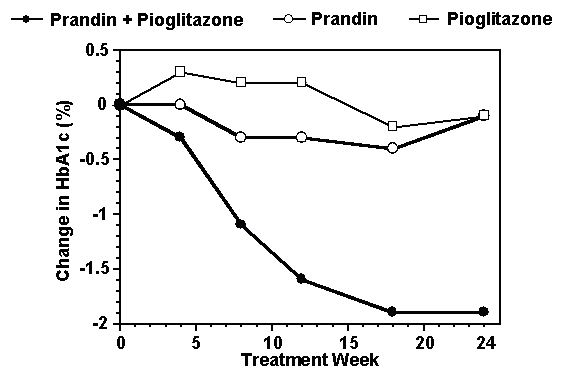
HbA1c värden per studievecka för patienter som avslutade studien (kombination, N = 101; Prandin, N = 35, pioglitazon, N = 26).
Personer med FPG över 270 mg / dL drogs ut från studien.
Pioglitazondos: fixerad till 30 mg / dag; Median slutdos för Prandin: 6 mg / dag för kombination och 10 mg / dag för monoterapi.
En kombinationsbehandlingsregim av Prandin och rosiglitazon jämfördes med monoterapi med båda medlen ensam i en 24-veckorsstudie som inkluderade 252 patienter som tidigare behandlats med sulfonylurea eller metformin (HbA1c > 7.0%). Kombinationsterapi resulterade i signifikant större förbättring av glykemisk kontroll jämfört med monoterapi (tabell nedan). De glykemiska effekterna av kombinationsterapin var dosbesparande med avseende på både total daglig dos av Prandin och total daglig dos av rosiglitazon (se tabellförklaring). Ett större effektrespons i kombinationsterapigruppen uppnåddes med hälften av den median dagliga dosen av Prandin och rosiglitazon, jämfört med respektive monoterapigrupper. Genomsnittlig viktförändring associerad med kombinationsterapi var större än Prandin-monoterapi.
Genomsnittliga förändringar från baslinjen i glykemiska parametrar och vikt i en 24-veckors prandin / rosiglitazon-kombinationstudie *
| Prandin | Kombination | rosiglitazon | |
| N | 63 | 127 | 62 |
| HbA1c (%) | |||
| Baseline | 9.3 | 9.1 | 9.0 |
| Byt med 24 veckor | -0.17 | -1.43** | -0.56 |
| FPG (mg / dL) | |||
| Baseline | 269 | 257 | 252 |
| Byt med 24 veckor | -54 | -94** | -67 |
| Viktförändring (kg) | +1.3 | +4.5*** | +3.3 |
Slutliga median doser: rosiglitazon - 4 mg / dag för kombination och 8 mg / dag för monoterapi; Prandin - 6 mg / dag för kombination och 12 mg / dag för monoterapi |
* baserat på avsikt att behandla analys
** p-värde â ‰ ¤ 0,001 för jämförelse med endera monoterapi
*** p-värde <0,001 för jämförelse med Prandin
topp
Indikationer och användning
Prandin indikeras som en tillsats till kost och träning för att förbättra glykemisk kontroll hos vuxna med typ 2-diabetes mellitus.
topp
Kontra
Prandin är kontraindicerat hos patienter med:
- Diabetisk ketoacidos, med eller utan koma. Detta tillstånd bör behandlas med insulin.
- Typ 1-diabetes.
- Känd överkänslighet mot läkemedlet eller dess inaktiva ingredienser.
topp
försiktighetsåtgärder
Allmän:
Prandin är inte indicerat för användning i kombination med NPH-insulin (se NEGATIVA REAKTIONER, Kardiovaskulära händelser)
Makrovaskulära resultat:
Det har inte förekommit några kliniska studier som visar avgörande bevis på makrovaskulär riskreduktion med Prandin eller något annat diabetiskt läkemedel.
hypoglykemi:
Alla orala blodsockersänkande läkemedel inklusive repaglinid kan producera hypoglykemi. Rätt patientval, dosering och instruktioner till patienterna är viktiga för att undvika hypoglykemiska episoder. Nedsatt leverfunktion kan orsaka förhöjda repaglinidblodnivåer och kan minska glukoneogen kapacitet, som båda ökar risken för allvarlig hypoglykemi. Äldre, försvagade eller undernärda patienter och de med binjurar, hypofysen, lever eller svårt nedsatt njurfunktion kan vara särskilt mottaglig för den hypoglykemiska effekten av glukos-sänkning läkemedel.
Hypoglykemi kan vara svår att känna igen hos äldre och hos personer som tar beta-adrenerga blockerande läkemedel. Det är mer troligt att hypoglykemi inträffar när kaloriintaget är bristfälligt, efter svår eller långvarig träning, när alkohol intas eller när mer än ett glukoslägre läkemedel används.
Frekvensen av hypoglykemi är större hos patienter med typ 2-diabetes som inte tidigare har behandlats med orala blodsockereducerande läkemedel (nave) eller vars HbA1c är mindre än 8%. Prandin ska administreras med måltider för att minska risken för hypoglykemi.
Förlust av kontroll av blodglukos:
När en patient som stabiliserats på något diabetesprogram utsätts för stress såsom feber, trauma, infektion eller operation, kan en förlust av glykemisk kontroll uppstå. Vid sådana tillfällen kan det vara nödvändigt att avbryta Prandin och administrera insulin. Effektiviteten av vilket hypoglykemiskt läkemedel som helst för att sänka blodglukosen till en önskad nivå minskar hos många patienter över en tidsperiod, som kan bero på progression av svårighetsgraden av diabetes eller minskad lyhördhet för läkemedel. Detta fenomen är känt som sekundär misslyckande, för att skilja det från primärt fel, där läkemedlet är ineffektivt hos en individuell patient när läkemedlet först ges. Tillräcklig justering av dos och anslutning till diet bör bedömas innan en patient klassificeras som ett sekundärt misslyckande.
Information för patienter
Patienterna bör informeras om potentiella risker och fördelar med Prandin och om alternativa terapimetoder. De bör också informeras om vikten av att följa dietinstruktioner, om ett regelbundet träningsprogram och om regelbundna tester av blodsocker och HbA1c. Riskerna för hypoglykemi, dess symtom och behandling, och tillstånd som predisponerar för dess utveckling och samtidig administrering av andra glukosesänkande läkemedel bör förklaras för patienter och ansvarig familj medlemmar. Primärt och sekundärt fel bör också förklaras.
Patienterna bör instrueras att ta Prandin före måltid (2, 3 eller 4 gånger om dagen i förväg). Doserna tas vanligtvis inom 15 minuter efter måltiden men tiden kan variera från omedelbart före måltiden till så länge som 30 minuter före måltiden. Patienter som hoppar över en måltid (eller lägger till en extra måltid) bör instrueras att hoppa över (eller lägga till) en dos för den måltiden.
Laboratorietester
Svaret på alla diabetiska behandlingar bör övervakas genom periodiska mätningar av fastande blod glukos- och glykosylerade hemoglobinnivåer med målet att minska dessa nivåer mot det normala räckvidd. Under dosjustering kan fasta glukos användas för att bestämma det terapeutiska svaret. Därefter bör både glukos och glykosylerat hemoglobin övervakas. Glykosylerat hemoglobin kan vara särskilt användbart för utvärdering av långsiktig glykemisk kontroll. Efterprandial glukosnivåundersökning kan vara kliniskt användbar hos patienter vars blodglukosnivåer före måltid är tillfredsställande men vars totala glykemisk kontroll (HbA1c) är otillräcklig.
Drug-Drug Interactions
In vitro-data indikerar att Prandin metaboliseras av cytokrom P450-enzymer 2C8 och 3A4. Följaktligen kan repaglinidmetabolismen förändras av läkemedel som påverkar dessa cytokrom P450-enzymsystem via induktion och hämning. Försiktighet bör därför vidtas hos patienter som är på Prandin och som tar hämmare och / eller inducerare av CYP2C8 och CYP3A4. Effekten kan vara mycket signifikant om båda enzymerna hämmas samtidigt vilket resulterar i en avsevärd ökning av plasmakoncentrationerna av repaglinid. Läkemedel som är kända för att hämma CYP3A4 inkluderar svampmedel som ketokonazol, itrakonazol och antibakteriella medel som erytromycin. Läkemedel som är kända för att hämma CYP2C8 inkluderar medel som trimetoprim, gemfibrozil och montelukast. Läkemedel som inducerar CYP3A4- och / eller 2C8-enzymsystemen inkluderar rifampin, barbiturater och karbamezapin. Ser KLINISK FARMAKOLOGI avsnitt, Drug-Drug Interactions.
In vivo-data från en studie som utvärderade samadministrering av ett cytokrom P450-enzym 3A4 hämmare, klaritromycin, med Prandin resulterade i en kliniskt signifikant ökning av repaglinid plasmanivåer. Dessutom observerades en ökning av plasmakoncentrationerna av repaglinid i en studie som utvärderade samtidig administrering av Prandin med trimetoprim, en cytokrom P-450-enzym 2C8-hämmare. Dessa ökningar i repaglinidplasmanivåer kan kräva en justering av Prandin. Ser KLINISK FARMAKOLOGIavsnitt, Drug-Drug Interactions.
In vivo-data från en studie som utvärderade samtidig administrering av gemfibrozil och Prandin hos friska försökspersoner resulterade i en signifikant ökning av repaglinidblodnivåer. Patienter som tar Prandin bör inte börja ta gemfibrozil; patienter som tar gemfibrozil bör inte börja ta Prandin. Samtidig användning kan resultera i förbättrade och förlängda effekter av blodsocker av repaglinid. Försiktighet bör vidtas hos patienter som redan har Prandin och gemfibrozil - blodsockernivåerna bör övervakas och Prandin-dosjustering kan behövas. Sällsynta händelser efter allvarlig hypoglykemi har rapporterats hos patienter som tagit Prandin och gemfibrozil tillsammans. Gemfibrozil och itraconazol hade en synergistisk metabolisk hämmande effekt på Prandin. Därför ska patienter som tar Prandin och gemfibrozil inte ta itrakonazol. Ser KLINISK FARMAKOLOGI avsnitt, Drug-Drug Interactions.
Den hypoglykemiska effekten av orala blodsockersänkande medel kan förstärkas av vissa läkemedel inklusive icke-steroida antiinflammatoriska medel och andra läkemedel. som är starkt proteinbundna, salicylater, sulfonamider, kloramfenikol, kumariner, probenecid, monoaminoxidashämmare och beta-adrenerg blockering medel. När sådana läkemedel administreras till en patient som får orala blodsockersänkande medel, bör patienten observeras noggrant för hypoglykemi. När sådana läkemedel dras ut från en patient som får orala blodsockersänkande medel, bör patienten observeras noggrant för förlust av glykemisk kontroll.
Vissa läkemedel tenderar att producera hyperglykemi och kan leda till förlust av glykemisk kontroll. Dessa läkemedel inkluderar tiazider och andra diuretika, kortikosteroider, fenotiaziner, sköldkörtelprodukter, östrogener, orala preventivmedel, fenytoin, nikotinsyra, sympatomimetika, kalciumkanalblockerande läkemedel och isoniazid. När dessa läkemedel administreras till en patient som får orala blodsockersänkande medel bör patienten observeras för förlust av glykemisk kontroll. När dessa läkemedel dras ut från en patient som får orala blodsockersänkande medel, bör patienten observeras noggrant för hypoglykemi.
Karcinogenes, mutagenes och nedsatt fertilitet
Långtidsstudier av karcinogenicitet utfördes under 104 veckor i doser upp till och med 120 mg / kg kroppsvikt / dag (råttor) och 500 mg / kg kroppsvikt / dag (möss) eller ungefär 60 respektive 125 gånger klinisk exponering på en mg / m2 grund. Inga bevis på karcinogenicitet hittades hos möss eller honråttor. Hos hanråttor var det en ökad förekomst av godartade adenom i sköldkörteln och levern. Relevansen av dessa fynd för människor är oklar. Ingen effektdoserna för dessa observationer hos hanråttor var 30 mg / kg kroppsvikt / dag för sköldkörteltumörer och 60 mg / kg kroppsvikt / dag för levertumörer, som är över 15 respektive 30 gånger klinisk exponering på en mg / m2 grund.
Repaglinid var icke-genotoxiskt i ett batteri in vivo- och in vitro-studier: Bakteriell mutagenes (Ames-test), in vitro-mutationsanalys in vitro i V79-celler (HGPRT), in vitro kromosomal aberrationsanalys i humana lymfocyter, oplanerad och replikerande DNA-syntes i råttlever och in vivo mus- och råttmikronukleus tester.
Fertiliteten hos hanråttor och honråttor påverkades inte av administrering av repaglinid i doser upp till 80 mg / kg kroppsvikt / dag (kvinnor) och 300 mg / kg kroppsvikt / dag (män); över 40 gånger klinisk exponering på mg / m2-basis.
Graviditet
Graviditet kategori C
Teratogena effekter
Säkerhet hos gravida kvinnor har inte fastställts. Repaglinid var inte teratogent hos råttor eller kaniner i doser 40 gånger (råttor) och cirka 0,8 gånger (kanin) klinisk exponering (på mg / m2 basis) under hela graviditeten. Eftersom djurreproduktionsstudier inte alltid förutsäger mänskligt svar, bör Prandin användas under graviditet endast om det är klart nödvändigt.
Eftersom ny information tyder på att onormala blodsockernivåer under graviditeten är förknippade med en högre förekomst av medfödda avvikelser, rekommenderar många experter att insulin används under graviditet för att upprätthålla blodsockernivåer så nära det normala som möjligt.
Nonteratogena effekter
Avkomma av råttadammar exponerade för repaglinid vid 15 gånger klinisk exponering på mg / m2-basis under dagarna 17 till 22 i graviditeten amning utvecklade nonteratogena skelettdeformiteter bestående av förkortning, förtjockning och böjning av humerus under postnatalt period. Denna effekt sågs inte vid doser upp till 2,5 gånger klinisk exponering (på mg / m2-basis) på dagarna 1 till 22 av graviditeten eller vid högre doser som gavs under dagarna 1 till 16 av graviditeten. Relevant exponering för människa har inte inträffat hittills och därför kan säkerheten vid administrering av Prandin under graviditet eller amning inte fastställas.
Ammande mödrar
I reproduktionsstudier av råttor detekterades mätbara nivåer av repaglinid i bröstmjölken hos dammarna och sänkta blodsockernivåer observerades i valparna. Korsfrämjande studier indikerade att skelettförändringar (se Nonteratogenic effekter ovan) kunde induceras i kontrollvalpar som vårdas av behandlade dammar, även om detta inträffade i mindre grad än de valpar som behandlades i utero. Även om det inte är känt om repaglinid utsöndras i bröstmjölk är det känt att några orala medel utsöndras på denna väg. Eftersom potentialen för hypoglykemi hos ammande spädbarn kan finnas, och på grund av effekterna på ammande djur, a beslut bör fattas om Prandin ska avbrytas hos ammande mödrar eller om mödrar bör avbryta amning. Om Prandin avbryts och om dieten enbart är otillräcklig för att kontrollera blodsockret, bör insulinbehandling övervägas.
Pediatrisk användning
Inga studier har utförts på barn.
Geriatrisk användning
I kliniska repaglinidstudier på 24 veckor eller längre var 415 patienter över 65 år. I ett års aktivt kontrollerade studier sågs inga skillnader i effektivitet eller biverkningar mellan dessa försökspersoner och de mindre än 65 andra än den förväntade åldersrelaterade ökningen av kardiovaskulära händelser som observerats för Prandin och komparator läkemedel. Det var ingen ökning i frekvens eller svårighetsgrad av hypoglykemi hos äldre personer. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men en större känslighet hos vissa äldre individer för Prandin-terapi kan inte regleras ut.
topp
Negativa reaktioner
Hypoglykemi: Se FÖRSIKTIGHETSÅTGÄRDER ochÖVERDOSERING sektioner.
Prandin har administrerats till 2931 individer under kliniska studier. Cirka 1500 av dessa individer med typ 2-diabetes har behandlats i minst 3 månader, 1000 under minst 6 månader och 800 under minst ett år. Majoriteten av dessa individer (1228) fick Prandin i en av fem 1-åriga, aktivt kontrollerade studier. Jämförande läkemedel i dessa 1-åriga studier var orala sulfonylurea-läkemedel (SU) inklusive glyburid och glipizid. Under ett år avbröts 13% av Prandin-patienterna på grund av biverkningar, liksom 14% av SU-patienterna. De vanligaste biverkningarna som ledde till abstinens var hyperglykemi, hypoglykemi och relaterade symtom (se FÖRSIKTIGHETSÅTGÄRDER). Mild eller måttlig hypoglykemi förekom hos 16% av Prandin-patienterna, 20% av glyburidpatienterna och 19% av glipizidpatienterna.
Tabellen nedan visar vanliga biverkningar för Prandin-patienter jämfört med både placebo (i studier mellan 12 och 24 veckor) och med glyburid och glipizid i ett års studier. Profilen för biverkningar av Prandin var i allmänhet jämförbar med den för sulfonylurea-läkemedel (SU).
Vanliga rapporterade biverkningar (% av patienterna) *
| HÄNDELSE | Prandin |
PLACEBO | Prandin |
SU |
| N = 352 | N = 108 | N = 1228 | N = 498 | |
| Placebokontrollerade studier | Aktiva kontrollerade studier | |||
| metabola | ||||
| hypoglykemi | 31** | 7 | 16 | 20 |
| Respiratory | ||||
| URI | 16 | 8 | 10 | 10 |
| Bihåleinflammation | 6 | 2 | 3 | 4 |
| rinit | 3 | 3 | 7 | 8 |
| Bronkit | 2 | 1 | 6 | 7 |
| gastrointestinal | ||||
| Illamående | 5 | 5 | 3 | 2 |
| Diarre | 5 | 2 | 4 | 6 |
| Förstoppning | 3 | 2 | 2 | 3 |
| kräkningar | 3 | 3 | 2 | 1 |
| Dyspepsi | 2 | 2 | 4 | 2 |
| musculoskeletal | ||||
| artralgi | 6 | 3 | 3 | 4 |
| Ryggont | 5 | 4 | 6 | 7 |
| Övrig | ||||
| Huvudvärk | 11 | 10 | 9 | 8 |
| parestesi | 3 | 3 | 2 | 1 |
| Bröstsmärta | 3 | 1 | 2 | 1 |
| Urinvägsinfektion | 2 | 1 | 3 | 3 |
| Tandsjukdom | 2 | 0 | <1 | <1 |
| Allergi | 2 | 0 | 1 | <1 |
* Händelser ≠2% för Prandin-gruppen i placebokontrollerade studier och â ¥ händelser i placebogruppen
** Se provbeskrivning i KLINISK FARMAKOLOGI, Kliniska tester.
Kardiovaskulära händelser
I ett års studier som jämförde Prandin med sulfonylurea-läkemedel var förekomsten av angina jämförbar (1,8%) för båda behandlingarna, med en förekomst av bröstsmärtor på 1,8% för Prandin och 1,0% för sulfonylureor. Förekomsten av andra utvalda kardiovaskulära händelser (hypertoni, onormal EKG, myokardie) infarkt, arytmier och hjärtklappning) var 1% och inte olika mellan Prandin och komparatorläkemedel.
Förekomsten av totala allvarliga kardiovaskulära biverkningar, inklusive ischemi, var högre för repaglinid (4%) än för sulfonylurea-läkemedel (3%) i kontrollerade jämförande kliniska studier. I 1-åriga kontrollerade studier var Prandin-behandling inte associerad med överdödlighet jämfört med de observerade frekvenserna med andra orala hypoglykemiska medel.
Sammanfattning av allvarliga kardiovaskulära händelser (% av de totala patienterna med händelser) i prövningar med jämförelse av prandin med sulfonylureas
| Prandin | SU | |
| Totalt exponerat | 1228 | 498 |
| Allvarliga CV-händelser | 4% | 3% |
| Ischemiska händelser i hjärtat | 2% | 2% |
| Dödsfall på grund av CV-händelser | 0.5% | 0.4% |
* glyburid och glipizide
Sju kontrollerade kliniska studier inkluderade Prandin-kombinationsterapi med NPH-insulin (n = 431), insulin formuleringar ensamma (n = 388) eller andra kombinationer (sulfonylurea plus NPH-insulin eller Prandin plus metformin) (N = 120). Det var sex allvarliga biverkningar av myokardiell ischemi hos patienter som behandlades med Prandin plus NPH-insulin från två studier och en händelse hos patienter som använder insulinformuleringar ensamma från en annan studie.
Sällsynta biverkningar (<1% av patienterna)
Mindre vanliga biverkningar eller laboratoriehändelser som observerats i kliniska studier inkluderade förhöjda leverenzymer, trombocytopeni, leukopeni och anafylaktoida reaktioner.
Även om det inte har konstaterats någon kausal relation med repaglinid, inkluderar erfarenheter efter marknadsföring rapporter om följande sällsynta biverkningar: alopecia, hemolytisk anemi, pankreatit, Stevens-Johnson syndrom och svår leverfunktion inklusive gulsot och hepatit.
Kombinationsterapi med tiazolidindioner
Under 24 veckors behandling har kliniska prövningar av Prandin-rosiglitazon eller Prandin-pioglitazon kombinationsterapi (totalt 250 patienter i kombinationsterapi) hypoglykemi (blodglukos <50 mg / dL) inträffade hos 7% av patienter med kombinationsterapi jämfört med 7% för monoterapi med Prandin och 2% för tiazolidinedion monoterapi.
Perifert ödem rapporterades hos 12 av 250 patienter med kombinationsterapi av Prandin-tiazolidinedion och 3 av 124 patienter med monoterapi med tiazolidinedion, utan några fall rapporterade i dessa studier med Prandin monoterapi. När korrigerat för bortfall av behandlingsgrupperna, andelen patienter som har händelser av perifert ödem per 24 veckors behandling var 5% för kombinationsterapi av Prandin-tiazolidinedion och 4% för tiazolidinedione monoterapi. Det rapporterades hos 2 av 250 patienter (0,8%) som behandlades med Prandin-tiazolidinedion-terapi av episoder med ödem med kongestiv hjärtsvikt. Båda patienterna hade tidigare en kranskärlssjukdom och återhämtade sig efter behandling med diuretika. Inga jämförbara fall rapporterades i monoterapibehandlingsgrupperna.
Genomsnittlig viktförändring från baslinjen var +4,9 kg för behandling med Prandin-tiazolidinedion. Det fanns inga patienter på Prandin-tiazolidinedione-kombinationsterapi som hade förhöjningar av levertransaminaser (definierade som 3 gånger den övre gränsen för normala nivåer).
topp
Överdos
I en klinisk prövning fick patienterna ökande doser av Prandin upp till 80 mg per dag under 14 dagar. Det fanns få biverkningar andra än de som var förknippade med den avsedda effekten av att sänka blodglukos. Hypoglykemi inträffade inte när måltider gavs med dessa höga doser. Hypoglykemiska symtom utan medvetenhetsförlust eller neurologiska fynd bör behandlas aggressivt med oral glukos och justeringar i läkemedelsdosering och / eller måltidsmönster. En noggrann övervakning kan fortsätta tills läkaren är säker på att patienten är utan risk. Patienter bör övervakas noggrant i minst 24 till 48 timmar, eftersom hypoglykemi kan återkomma efter uppenbar klinisk återhämtning. Det finns inga bevis för att repaglinid är dialyserbar med hjälp av hemodialys.
Allvarliga hypoglykemiska reaktioner med koma, anfall eller annan neurologisk nedsättning förekommer sällan, men utgör medicinska nödsituationer som kräver omedelbar sjukhusvistelse. Om hypoglykemisk koma diagnostiseras eller misstänks, ska patienten ges en snabb intravenös injektion av koncentrerad (50%) glukoslösning. Detta bör följas av en kontinuerlig infusion av mer utspädd (10%) glukoslösning med en hastighet som håller blodglukosen på en nivå över 100 mg / dL.
topp
Dosering och administrering
Det finns ingen fast doseringsplan för hantering av typ 2-diabetes med Prandin.
Patientens blodsocker bör övervakas regelbundet för att bestämma den minsta effektiva dosen för patienten; att detektera primärt fel, dvs otillräcklig sänkning av blodglukos vid den maximala rekommenderade dosen av medicinering; och för att upptäcka sekundär misslyckande, dvs förlust av ett adekvat blodsockersänkande svar efter en initial effektivitetsperiod. Glykosylerade hemoglobinnivåer är av värde för att övervaka patientens längre svar på terapi.
Kortvarig administrering av Prandin kan vara tillräckligt under perioder med kortvarig förlust av kontroll hos patienter som vanligtvis är välkontrollerade på diet.
Prandindoser tas vanligtvis inom 15 minuter efter måltiden men tiden kan variera från omedelbart före måltiden till så länge som 30 minuter före måltiden.
Startdos
För patienter som inte tidigare behandlats eller vars HbA1c är <8% bör startdosen vara 0,5 mg för varje måltid. För patienter som tidigare behandlats med blodsockersänkande läkemedel och vars HbA1c är â € 8% är den initiala dosen 1 eller 2 mg för varje måltid i förväg (se föregående stycke).
Dosjustering
Dosjusteringar bör bestämmas med blodglukosrespons, vanligtvis fastande blodglukos. Testning efter glukosnivåer efter prandial kan vara kliniskt användbar hos patienter vars blodglukosnivåer före måltid är tillfredsställande men vars totala glykemisk kontroll (HbA1c) är otillräcklig. Den preprandiala dosen bör fördubblas upp till 4 mg med varje måltid tills tillfredsställande blodglukosrespons uppnås. Minst en vecka bör gå för att utvärdera svaret efter varje dosjustering.
Det rekommenderade dosintervallet är 0,5 mg till 4 mg taget med måltider. Prandin kan doseras preprandiellt 2, 3 eller 4 gånger om dagen som svar på förändringar i patientens målmönster. Den maximala rekommenderade dagliga dosen är 16 mg.
Patienthantering
Långsiktig effekt bör övervakas genom mätning av HbA1c-nivåer ungefär var tredje månad. Underlåtenhet att följa en lämplig dosering kan utfälla hypoglykemi eller hyperglykemi. Patienter som inte följer deras föreskrivna diet- och läkemedelsregim är mer benägna att uppvisa otillfredsställande svar på terapi inklusive hypoglykemi. När hypoglykemi uppstår hos patienter som tar en kombination av Prandin och en tiazolidindion eller Prandin och metformin, ska Prandin-dosen minskas.
Patienter som får andra orala hypoglykemiska medel
När Prandin används för att ersätta terapi med andra orala hypoglykemiska medel, kan Prandin startas dagen efter att den slutliga dosen har givits. Patienter bör sedan observeras noggrant för hypoglykemi på grund av potentiell överlappning av läkemedelseffekter. När de överförs från längre halveringstid sulfonylurea medel (t.ex. klorpropamid) till repaglinid, kan noggrann övervakning indikeras i upp till en vecka eller längre.
Kombinationsterapi
Om Prandin monoterapi inte leder till adekvat glykemisk kontroll, kan metformin eller en tiazolidindion tillsättas. Om metformin eller tiazolidindion-monoterapi inte ger tillräcklig kontroll, kan Prandin läggas till. Startdos och dosjusteringar för Prandin-kombinationsterapi är desamma som för Prandin-monoterapi. Dosen för varje läkemedel bör justeras noggrant för att bestämma den minimala dos som krävs för att uppnå den önskade farmakologiska effekten. Underlåtenhet att göra detta kan leda till en ökning av förekomsten av hypoglykemiska avsnitt. Lämplig övervakning av FPG- och HbA1c-mätningar bör användas för att säkerställa att patienten inte utsätts för överdriven läkemedelseksponering eller ökad sannolikhet för sekundär läkemedelsfel.
topp
Hur levereras
Prandin (repaglinid) tabletter tillhandahålls som oscorerade, bikonvexa tabletter tillgängliga i 0,5 mg (vit), 1 mg (gul) och 2 mg (persika) styrka. Tabletter är präglade med tjursymbolen Novo Nordisk (Apis) och färgade för att indikera styrka.
| 0,5 mg tabletter (vita) | Flaskor på 100 | NDC 00169-0081-81 |
| Flaskor på 500 | NDC 00169-0081-82 | |
| Flaskor på 1000 | NDC 00169-0081-83 | |
| 1 mg tabletter (gul) | Flaskor på 100 | NDC 00169-0082-81 |
| Flaskor på 500 | NDC 00169-0082-82 | |
| Flaskor på 1000 | NDC 00169-0082-83 | |
| 2 mg tabletter (persika) | Flaskor på 100 | NDC 00169-0084-81 |
| Flaskor på 500 | NDC 00169-0084-82 | |
| Flaskor på 1000 | NDC 00169-0084-83 |
Förvara inte över 25 ° C.
Skydda mot fukt. Håll flaskorna tätt stängda.
Dispenser i trånga behållare med säkerhetsstängningar.
Licensierat enligt US patent nr RE 37,035.
Prandin® är ett registrerat varumärke som tillhör Novo Nordisk A / S.
Tillverkad i Tyskland för
Novo Nordisk Inc.
Princeton, NJ 08540
1-800-727-6500
www.novonordisk-us.com
© 2003-2008 Novo Nordisk A / S
Prandin, patientinformation (på vanligt engelska)
Detaljerad information om tecken, symtom, orsaker, behandling av diabetes
senast uppdaterad 06/2009
Informationen i denna monografi är inte avsedd att täcka alla möjliga användningar, anvisningar, försiktighetsåtgärder, läkemedelsinteraktioner eller negativa effekter. Denna information är generaliserad och är inte avsedd som specifik medicinsk rådgivning. Om du har frågor om läkemedlen du tar eller vill ha mer information, kontakta din läkare, apotekspersonal eller sjuksköterska.
tillbaka till: Bläddra bland alla mediciner för diabetes



