Nuvigil: Överdriven sömnbehandling (fullständig förskrivningsinformation)
Varumärke: Nuvigil
Generiskt namn: armodafinil
Nuvigil® (armodafinil) tabletter [C-IV]
Armodafinil är ett läkemedel som främjar vakenhet som är tillgänglig som Nuvigil används för att behandla sömnapné, narkolepsi eller sömnsjukdom i skiftarbete. Användning, dosering, biverkningar.
Innehåll:
Beskrivning
Klinisk farmakologi
Kliniska tester
Indikationer och användning
Kontra
varningar
försiktighetsåtgärder
Negativa reaktioner
Drogmissbruk och beroende
Överdos
Dosering och administrering
Hur levereras
Nuvigil patientinformationsblad (på vanligt engelska)
Beskrivning
NUVIGIL® (armodafinil) är ett vakenhetsfrämjande medel för oral administrering. Armodafinil är R-enantiomeren av modafinil som är en blandning av R- och S-enantiomererna. Det kemiska namnet på armodafinil är 2 - [(R) - (difenylmetyl) sulfinyl] acetamid. Molekylformeln är C15H15NEJ2S och molekylvikten är 273,35.
Den kemiska strukturen är:
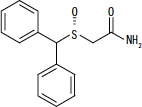
Armodafinil är ett vitt till benvitt, kristallint pulver som är mycket svagt lösligt i vatten, sparsamt lösligt i aceton och lösligt i metanol. NUVIGIL tabletter innehåller 50, 150 eller 250 mg armodafinil och följande inaktiva ingredienser: croscarmellose natrium, laktosmonohydrat, magnesiumstearat, mikrokristallin cellulosa, povidon och förgelatiniserat stärkelse.
topp
Klinisk farmakologi
Handlingsmekanism och farmakologi
Den exakta mekanismen genom vilken armodafinil (R-enantiomer) eller modafinil (blandning av R- och S-enantiomerer) främjar vakenhet är okänd. Både armodafinil och modafinil har visat liknande farmakologiska egenskaper i icke-kliniska djur- och in vitro-studier, i den omfattning som testades.
fortsätt historien nedan
Vid farmakologiskt relevanta koncentrationer binder inte eller hämmar armodafinil flera receptorer och enzymer som är potentiellt relevanta för sömn / väckningsreglering, inklusive sådana för serotonin, dopamin, adenosin, galanin, melatonin, melanocortin, orexin-1, orphanin, PACAP eller bensodiazepiner eller transportörer för GABA, serotonin, norepinefrin och kolin eller fosfodiesteras VI, COMT, GABA-transaminas och tyrosin hydroxylas. Modafinil hämmar inte aktiviteten hos MAO-B eller fosfodiesteraser II-IV.
Modafinil-inducerad vakenhet kan dämpas av den Î ± 1-adrenerga receptorantagonisten, prazosin; modafinil är emellertid inaktiv i andra in vitro-analyssystem som är kända för att vara känsliga för Î ± -adrenerga agonister, såsom beredning av rått vas deferens.
Armodafinil är inte en direkt- eller indirektverkande dopaminreceptoragonist. In vitro binder emellertid både armodafinil och modafinil till dopamintransportören och hämmar återupptag av dopamin. För modafinil har denna aktivitet associerats in vivo med ökade extracellulära dopaminnivåer i vissa hjärnregioner hos djur. Hos genetiskt konstruerade möss som saknade dopamintransportören (DAT), saknade modafinil väckefrämjande aktivitet, vilket tyder på att denna aktivitet var DAT-beroende. De väckningsfrämjande effekterna av modafinil, till skillnad från amfetamin, antagoniserades emellertid inte av dopaminreceptorantagonisten haloperidol i råttor.
Dessutom blockerar alfa-metyl-p-tyrosin, en dopaminsyntesinhibitor, effekten av amfetamin, men blockerar inte lokomotorisk aktivitet inducerad av modafinil.
Armodafinil och modafinil har väckefrämjande åtgärder liknande sympatomimetiska medel inklusive amfetamin och metylfenidat, även om deras farmakologiska profil inte är identisk med den sympatomimetiska aminer. Utöver dess väckefrämjande effekter och förmågan att öka den rörliga aktiviteten hos djur, producerar modafinil psykoaktiva och euforiska effekter, förändringar i humör, uppfattning, tänkande och känslor som är typiska för andra CNS-stimulanser i människor. Modafinil har förstärkande egenskaper, vilket framgår av dess självadministrering hos apor som tidigare tränats för att själv administrera kokain; modafinil diskriminerades också delvis som stimulantliknande.
Baserat på icke-kliniska studier verkar inte två huvudmetaboliter, syra och sulfon, av modafinil eller armodafinil, bidra till de moderföreningarnas CNS-aktiverande egenskaper.
farmakokinetik
Den aktiva komponenten i NUVIGIL är armodafinil, som är den längre livslängda enantiomeren av modafinil. NUVIGIL uppvisar linjär tidsoberoende kinetik efter administrering av enkel och multipel oral dos. Ökning av systemisk exponering är proportionell över dosområdet 50 till 400 mg. Ingen tidsberoende förändring i kinetik observerades under 12 veckors dosering. Det uppenbara stabila tillståndet för NUVIGIL uppnåddes inom sju dagar efter doseringen. Vid stabil tillstånd är den systemiska exponeringen för NUVIGIL 1,8 gånger den exponering som observerats efter en enda dos. Koncentrationstidsprofilerna för den rena enantiomeren efter administrering av 50 mg NUVIGIL eller 100 mg PROVIGIL® (modafinil) är nästan överlagliga.
Absorption
NUVIGIL absorberas lätt efter oral administrering. Den absoluta orala biotillgängligheten bestämdes inte på grund av den vattenhaltiga olösligheten av armodafinil, vilket förhindrade intravenös administrering. Maximal plasmakoncentration uppnås vid ungefär 2 timmar i fastande tillstånd. Livsmedelseffekt på den totala biotillgängligheten för NUVIGIL anses vara minimal; emellertid tid att nå toppkoncentrationen (tmax) kan försenas med cirka 2-4 timmar i det matade tillståndet. Eftersom förseningen i tmax är också förknippat med förhöjda plasmanivåer senare i tiden, livsmedel kan potentiellt påverka start och tid av farmakologiska verkningar för NUVIGIL.
Distribution
NUVIGIL har en uppenbar distributionsvolym på cirka 42 L. Data specifika för bindning av armodafinilprotein är inte tillgängliga. Modafinil är emellertid måttligt bundet till plasmaprotein (cirka 60%), främst till albumin. Potentialen för interaktioner av NUVIGIL med mycket proteinbundna läkemedel anses vara minimal.
Ämnesomsättning
In vitro- och in vivo-data visar att armodafinil genomgår hydrolytisk deamidering, S-oxidation och hydroxylering av aromatisk ring, med efterföljande glukuronidkonjugering av de hydroxylerade produkterna. Amidhydrolys är den enskilt mest framstående metaboliska vägen, varvid sulfonbildning med cytokrom P450 (CYP) 3A4 / 5 är nästa i vikt. De andra oxidativa produkterna bildas för långsamt in vitro för att möjliggöra identifiering av det eller de ansvariga enzymerna. Endast två metaboliter når märkbara koncentrationer i plasma (d.v.s. R-modafinilsyra och modafinilsulfon).
Data specifika för NUVIGIL-disposition är inte tillgängliga. Modafinil elimineras dock huvudsakligen via metabolism, främst i levern, med mindre än 10% av moderföreningen utsöndras i urinen. Totalt återvanns 81% av den administrerade radioaktiviteten 11 dagar efter dos, främst i urinen (80% mot 1,0% i avföringen).
Eliminering
Efter oral administrering av NUVIGIL uppvisar armodafinil en uppenbar monoexponential minskning från den maximala plasmakoncentrationen. Den uppenbara terminalen t ½ är ungefär 15 timmar. Den orala clearance av NUVIGIL är cirka 33 ml / min.
Drug-Drug Interaction
Förekomsten av flera vägar för armodafinil-metabolism, liksom det faktum att en icke-CYP-relaterad väg är den snabbaste i metaboliseringen av armodafinil, antyder att det finns en låg sannolikhet för substantiella effekter på den totala farmakokinetiska profilen för NUVIGIL på grund av CYP-hämning av samtidigt läkemedel.
In vitro-data visade att armodafinil visar ett svagt induktivt svar för CYP1A2 och eventuellt CYP3A aktiviteter på ett koncentrationsrelaterat sätt och att CYP2C19-aktivitet hämmas reversibelt av armodafinil. Andra CYP-aktiviteter tycktes inte påverkas av armodafinil. En in vitro-studie visade att armodafinil är ett substrat av P-glykoprotein.
Kronisk administration av NUVIGIL vid 250 mg minskade den systemiska exponeringen för midazolam med 32% och 17% efter en enda oral (5) respektive intravenös (2 mg) doser, vilket antyder att administration av NUVIGIL måttligt inducerar CYP3A aktivitet. Läkemedel som är substrat för CYP3A4 / 5, såsom cyklosporin, kan kräva dosjustering. (Ser försiktighetsåtgärder, Läkemedelsinteraktioner).
Kronisk administration av NUVIGIL vid 250 mg påverkade inte farmakokinetiken för koffein (200 mg), ett sondunderlag för CYP1A2-aktivitet.
Samtidig administrering av en enda 400 mg dos NUVIGIL och omeprazol (40 mg) ökade systemiskt exponering för omeprazol med cirka 40%, vilket indikerar att armodafinil måttligt hämmar CYP2C19 aktivitet. Läkemedel som är substrat för CYP2C19 kan kräva dosreduktion. (Ser försiktighetsåtgärder, Läkemedelsinteraktioner).
Könseffekt
Befolkningens farmakokinetiska analys tyder inte på någon könseffekt på farmakokinetiken för armodafinil.
Särskilda befolkningar
Data specifika för armodafinil i speciella populationer är inte tillgängliga.
Ålderseffekt: En lätt minskning (~ 20%) i den orala clearance (CL / F) av modafinil observerades i en enstaka dosstudie vid 200 mg i 12 individer med en medelålder på 63 år (intervall 53 - 72 år), men förändringen ansågs inte sannolikt vara kliniskt signifikant. I en flerdosstudie (300 mg / dag) på 12 patienter med en medelålder på 82 år (intervall 67 - 87 år), var medelvärdet nivåerna av modafinil i plasma var ungefär två gånger de som historiskt erhölls i matchade yngre ämnen. På grund av potentiella effekter från de flera samtidigt mediciner som de flesta patienter var med behandlad kan den uppenbara skillnaden i farmakokinetik för modafinil inte bero enbart på effekterna av åldrande. Resultaten tyder dock på att clearance av modafinil kan minskas hos äldre (se Dosering och administrering).
Race Effect: Påverkan av ras på modafinils farmakokinetik har inte studerats.
Nedsatt njurfunktion: I en engångsdos på 200 mg modafinil gjorde allvarligt kroniskt njursvikt (kreatininclearance - 20 ml / min) inte påverkade signifikant farmakokinetiken för modafinil, men exponeringen för modafinilsyra ökade 9 gånger (se försiktighetsåtgärder).
Nedsatt leverfunktion: Modafinils farmakokinetik och metabolism undersöktes hos patienter med skrump i levern (6 män och 3 kvinnor). Tre patienter hade skrump B eller B + cirrhos och 6 patienter hade skrump C eller C + cirrhos (enligt Child-Pugh-poängkriterierna). Kliniskt var 8 av 9 patienter icteriska och alla hade ascites. Hos dessa patienter minskade den orala clearance av modafinil med cirka 60% och koncentrationen av stabil tillstånd fördubblades jämfört med normala patienter. Dosen av NUVIGIL ska minskas hos patienter med allvarligt nedsatt leverfunktion (se avsnitt 1) försiktighetsåtgärder och Dosering och administrering).
topp
Kliniska tester
NUVIGIL: s effektivitet för att förbättra vakenheten har fastställts i följande sömn störningar: obstruktiv sömnapné / hypopnea syndrom (OSAHS), narkolepsi och sömnproblem i skiftarbete (SWSD).
För varje klinisk prövning krävdes ett p-värde på â0,05 för statistisk signifikans.
Obstruktiv sömnapné / hypopneasyndrom (OSAHS)
Effektiviteten hos NUVIGIL för att förbättra vakenheten hos patienter med överdriven sömnighet associerad med OSAHS fastställdes i två 12-veckors, multicenter, placebokontrollerade, parallellgrupp, dubbelblinda studier av öppenvårdare som mötte Internationella Klassificering av sömnstörningar (ICSD) -kriterier för OSAHS (som också överensstämmer med American Psychiatric Association) DSM-IV-kriterier). Dessa kriterier inkluderar antingen, 1) överdriven sömnighet eller sömnlöshet, plus frekventa episoder av nedsatt andas under sömnen, och tillhörande funktioner som hög snarkning, huvudvärk på morgonen eller munntorrhet uppvaknande; eller 2) överdriven sömnighet eller sömnlöshet; och polysomnografi som visar ett av följande: mer än fem obstruktiva apnéer, var och en mer än 10 sekunder i längd, per timmes sömn; och ett eller flera av följande: frekventa urval av sömn förknippade med apnéerna, bradytachykardi eller arteriell syreavmättnad i samband med apnéerna. Dessutom, för att delta i dessa studier, var alla patienter skyldiga att ha överdriven sömnighet som visat med en poäng â € 10 på Epworth Sleepiness Scale, trots behandling med kontinuerligt positivt luftvägstryck (CPAP). Bevis för att CPAP var effektivt för att minska episoder av apné / hypopnea krävdes tillsammans med dokumentation av CPAP-användning.
Patienterna var skyldiga att följa CPAP, definierat som CPAP-användning â € 4 timmar / natt på â € 70% av nätter. CPAP-användning fortsatte under hela studien. I båda studierna var de primära måtten på effektivitet 1) sömnfördröjning, bedömd med MWT (Maintain of Wakefulness Test) och 2) förändringen i patientens totala sjukdomstatus, mätt med den kliniska globala intrycket av förändring (CGI-C) vid den slutliga besök. För en framgångsrik studie måste båda åtgärderna visa statistiskt signifikant förbättring.
MWT mäter latens (i minuter) för att sova börjar. En utökad MWT utfördes med testsessioner med 2 timmars intervall mellan 09:00 och 19:00. Den primära analysen var medelvärdet av sömnlatenserna från de första fyra testsessionerna (09:00 till 15:00). För varje testsession ombads ämnet att försöka hålla sig vaken utan att använda extraordinära åtgärder. Varje testsession avslutades efter 30 minuter om ingen sömn inträffade eller omedelbart efter sömnens början. CGI-C är en 7-punktsskala, centrerad på Ingen förändring, och sträcker sig från mycket mycket värre till mycket förbättrad. Utvärderarna gavs ingen specifik vägledning om kriterierna som de skulle tillämpa vid bedömning av patienter.
I den första studien randomiserades totalt 395 patienter med OSAHS för att få NUVIGIL 150 mg / dag, NUVIGIL 250 mg / dag eller matchande placebo. Patienter behandlade med NUVIGIL visade en statistiskt signifikant förbättring av förmågan att förbli vaken jämfört med placebobehandlade patienter, mätt med MWT vid slutbesöket. Ett statistiskt signifikant större antal patienter som behandlades med NUVIGIL visade förbättring i det övergripande kliniska tillståndet enligt betyg enligt CGI-C-skalan vid slutbesöket. De genomsnittliga sömnfördröjningarna (i minuter) i MWT vid baslinjen för försöken visas i tabell 1 nedan, tillsammans med den genomsnittliga förändringen från baslinjen på MWT vid slutbesöket. Procentandelen av patienter som visade någon grad av förbättring av CGI-C i de kliniska studierna visas i tabell 2 nedan. De två doserna av NUVIGIL gav statistiskt signifikanta effekter av liknande storlekar på MWT och även på CGI-C.
I den andra studien randomiserades 263 patienter med OSAHS till antingen NUVIGIL 150 mg / dag eller placebo. Patienter behandlade med NUVIGIL visade en statistiskt signifikant förbättring av förmågan att förbli vaken jämfört med placebo-behandlade patienter, mätt med MWT [tabell 1]. Ett statistiskt signifikant större antal patienter som behandlades med NUVIGIL visade förbättring i det övergripande kliniska tillståndet enligt CGI-C-skalan [Tabell 2].
Nattsömn uppmätt med polysomnografi påverkades inte av användningen av NUVIGIL i någon studie.
narkolepsi
Effektiviteten av NUVIGIL för att förbättra vakenheten hos patienter med överdriven sömnighet (ES) associerad med narkolepsi fastställdes i en 12-veckors, multicenter, placebokontrollerad, parallellgrupp, dubbelblind studie av öppenvårdare som uppfyllde ICSD-kriterierna för narkolepsi. Totalt 196 patienter randomiserades för att få NUVIGIL 150 eller 250 mg / dag, eller matchande placebo. ICSD-kriterierna för narkolepsi inkluderar antingen 1) återkommande dagstoppar eller försvinner i sömn som uppträder nästan dagligen i minst tre månader plus plötslig bilateral förlust av postural muskelton i samband med intensiv känsla (kataplexi), eller 2) ett klagomål om överdriven sömnighet eller plötslig muskelsvaghet med tillhörande funktioner: sömnförlamning, hypnagogiska hallucinationer, automatiska beteenden, störd majoritet sömnepisod; och polysomnografi som visar ett av följande: sömn latenstid mindre än 10 minuter eller snabb ögonrörelse (REM) sömn latens mindre än 20 minuter och en multipel sömn Latency Test (MSLT) som visar en genomsnittlig sömnfördröjning på mindre än 5 minuter och två eller fler REM-perioder för sömnstart och ingen medicinsk eller psykisk störning står för symptom. För att delta i dessa studier var alla patienter skyldiga att ha objektivt dokumenterat överdriven sömnighet på dagen via MSLT med en sömnfördröjning på 6 minuter eller mindre och frånvaron av någon annan kliniskt signifikant aktiv medicinsk eller psykiatrisk oordning. MSLT, en objektiv polysomnografisk bedömning av patientens förmåga att somna i ett ostimulerande miljö, uppmätt latens (i minuter) till sömnstart i genomsnitt under fyra testsamlingar kl 2-timmars intervall. För varje testsamling fick personen veta att ligga tyst och försöka sova. Varje testsession avslutades efter 20 minuter om ingen sömn inträffade eller omedelbart efter sömnens början.
De primära måtten på effektivitet var: 1) sömnlatens som bedömdes med MWT (Maintain of Wakefulness Test) och 2) förändringen i patientens totala sjukdom status, mätt med det kliniska globala intrycket av förändring (CGI-C) vid det sista besöket (se KLINISKA TRIALER, OSAHS-avsnittet ovan för en beskrivning av dessa åtgärder). Varje MWT-testsession avslutades efter 20 minuter om ingen sömn inträffade eller omedelbart efter sömnens början i denna studie.
Patienter behandlade med NUVIGIL visade en statistiskt signifikant förbättrad förmåga att förbli vaken på MWT vid varje dos jämfört med placebo vid slutbesöket [Tabell 1]. Ett statistiskt signifikant större antal patienter som behandlades med NUVIGIL vid varje dos visade förbättring i det övergripande kliniska tillståndet enligt betyg enligt CGI-C-skalan vid slutbesöket [Tabell 2]
De två doserna av NUVIGIL gav statistiskt signifikanta effekter av liknande storlekar på CGI-C. Även om en statistiskt signifikant effekt på MWT observerades för varje dos, observerades storleken på effekten att vara större för den högre dosen.
Nattsömn mätt med polysomnography påverkades inte av användningen av NUVIGIL.
Shift Work Sleep Disorder (SWSD)
Effektiviteten av NUVIGIL för att förbättra vakenheten hos patienter med överdriven sömnighet i samband med SWSD demonstrerades i en 12-veckors, multicenter, dubbelblind, placebokontrollerad, parallellgrupp, klinisk rättegång. Totalt 254 patienter med kronisk SWSD randomiserades för att få NUVIGIL 150 mg / dag eller placebo. Alla patienter uppfyllde ICSD-kriterierna för kronisk SWSD [som överensstämmer med American Psychiatric Association DSM-IV-kriterier för Circadian Rhythm Sleep Disorder: Shift Work Type]. Dessa kriterier inkluderar 1) antingen: a) ett primärt klagomål om överdriven sömnighet eller sömnlöshet som tillfälligt är förknippat med en arbetsperiod (vanligtvis nattarbete) som inträffar under den vanliga sömnfasen, eller b) polysomnografi och MSLT visar förlust av ett normalt sömn-vakningsmönster (dvs störd kronobiologisk rytmicitet); och 2) ingen annan medicinsk eller psykisk störning står för symptomen, och 3) symptomen inte uppfyller kriterierna för alla andra sömnstörningar som producerar sömnlöshet eller överdriven sömnighet (t.ex. tidzonändring [jet lag] syndrom).
Det bör noteras att inte alla patienter med klagomål på sömnighet som också bedriver skiftarbete uppfyller kriterierna för diagnos av SWSD. I den kliniska prövningen registrerades endast patienter som var symptomatiska i minst 3 månader.
Inskrivna patienter var också skyldiga att arbeta minst 5 nattskift per månad, har överdriven sömnighet vid tiden för deras nattskift (MSLT-poäng - 6 ¤6 minuter) och har sömnlöshet på dagtid dokumenterad av polysomnogram på dagen (PSG).
De primära måtten på effektiviteten var 1) sömn latenstid, bedömd med Multiple Sleep Latency Test (MSLT) utförd under en simulerad nattskift vid det sista besöket, och 2) förändringen i patientens totala sjukdomsstatus, mätt med den kliniska globala intrycket av förändring (CGI-C) vid det sista besöket. (Ser Kliniska tester, Narkolepsi och OSAHS-avsnitt ovan för beskrivning av dessa åtgärder).
Patienter som behandlades med NUVIGIL visade en statistiskt signifikant förlängning under sömnen början jämfört med placebobehandlade patienter, mätt med MSLT på natten vid slutbesöket [Tabell 1]. Ett statistiskt signifikant större antal patienter som behandlades med NUVIGIL visade förbättring i det övergripande kliniska tillståndet enligt betyg enligt CGI-C-skalan vid slutbesöket [Tabell 2].
Dagssömn mätt med polysomnografi påverkades inte av användningen av NUVIGIL.
| Oordning | Mäta | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo | |||
* Betydligt annorlunda än placebo för alla studier (p <0,05) | |||||||
| Baseline | Förändra från baslinjen |
Baseline | Förändra från baslinjen |
Baseline | Byt från Baseline |
||
| OSAHS I | MWT | 21.5 | 1.7 | 23.3 | 2.2 | 23.2 | -1.7 |
| OSAHS II | MWT | 23.7 | 2.3 | - | - | 23.3 | -1.3 |
| narkolepsi | MWT | 12.1 | 1.3 | 9.5 | 2.6 | 12.5 | -1.9 |
| SWSD | MSLT | 2.3 | 3.1 | - | - | 2.4 | 0.4 |
| Oordning | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo |
* Betydligt annorlunda än placebo för alla studier (p <0,05) | |||
| OSAHS I | 71% | 74% | 37% |
| OSAHS II | 71% | - | 53% |
| narkolepsi | 69% | 73% | 33% |
| SWSD | 79% | - | 59% |
topp
Indikationer och användning
NUVIGIL är indicerat för att förbättra vakenheten hos patienter med överdriven sömnighet associerad med obstruktiv sömnapné / hypopneasyndrom, narkolepsi och sömnsjukdom i skiftarbete.
I OSAHS indikeras NUVIGIL som ett komplement till standardbehandling (er) för den underliggande hindringen. Om kontinuerligt positivt luftvägstryck (CPAP) är den behandling som valts för en patient, bör en maximal ansträngning behandlas med CPAP under en tillräcklig tidsperiod innan NUVIGIL påbörjas. Om NUVIGIL används tillsammans med CPAP, är uppmuntran till och periodisk bedömning av CPAP-efterlevnad nödvändig.
I alla fall är noggrann uppmärksamhet på diagnosen och behandlingen av den / de underliggande sömnproblemen (s) störst vikt. Förskrivare bör vara medvetna om att vissa patienter kan ha mer än en sömnstörning som bidrar till deras överdrivna sömnighet.
Effekten av NUVIGIL vid långvarig användning (mer än 12 veckor) har inte utvärderats systematiskt i placebokontrollerade studier. Den läkare som väljer att förskriva NUVIGIL under en längre tid hos patienter bör regelbundet utvärdera långsiktigt användbarhet för den enskilda patienten.
topp
Kontra
NUVIGIL är kontraindicerat hos patienter med känd överkänslighet mot modafinil och armodafinil eller dess inaktiva ingredienser.
topp
VARNINGAR
Serious Rash, inklusive Stevens-Johnson Syndrome
Allvarliga utslag som kräver sjukhusvistelse och avbrytande av behandling har rapporterats hos vuxna i samband med användning av armodafinil och hos vuxna och barn i samband med användning av modafinil, en racemisk blandning av S- och R-modafinil (det senare är armodafinil).
Armodafinil har inte studerats på pediatriska patienter i någon miljö och är inte godkänt för användning hos barn för någon indikation.
Inga allvarliga hudutslag har rapporterats i kliniska studier på vuxna (0 per 1 595) av armodafinil. Emellertid har fall av allvarligt utslag rapporterats hos vuxna efter marknadsföring. Eftersom armodafinil är R-isomeren för racemisk modafinil, kan en liknande risk för allvarligt utslag hos barn med armodafinil inte uteslutas.
I kliniska studier av modafinil (racematet) var förekomsten av utslag som resulterade i avbrott cirka 0,8% (13 per 1 855) hos barn (ålder <17 år); dessa utslag inkluderade 1 fall av möjligt Stevens-Johnson syndrom (SJS) och 1 fall av uppenbar överkänslighetsreaktion i flera organ. Flera av fallen var förknippade med feber och andra avvikelser (t.ex. kräkningar, leukopeni). Mediantiden för utslag som resulterade i avbrott var 13 dagar. Inga sådana fall observerades bland 380 barn som fick placebo. Inga allvarliga hudutslag har rapporterats i kliniska studier av vuxna (0 per 4 264) av modafinil. Sällsynta fall av allvarliga eller livshotande utslag, inklusive SJS, Toxic Epidermal Necrolysis (TEN), och Drug Rash with Eosinofili och systemiska symtom (DRESS) har rapporterats hos vuxna och barn i världen efter marknadsföring med modafinil. Rapporteringsgraden för TEN och SJS förknippad med modafinil-användning, som allmänt accepteras som en underskattning på grund av underrapportering, överstiger bakgrundshändelsefrekvensen. Uppskattningar av bakgrundsfrekvensen för dessa allvarliga hudreaktioner i den allmänna befolkningen varierar mellan 1 till 2 fall per miljon år.
Det finns inga faktorer som är kända för att förutsäga risken för förekomst eller svårighetsgraden av utslag i samband med armodafinil eller modafinil. Nästan alla fall av allvarligt utslag i samband med armodafinil eller modafinil inträffade inom 1 till 5 veckor efter behandlingsstart. Emellertid har isolerade fall rapporterats efter långvarig behandling med modafinil (t.ex. 3 månader). Följaktligen kan inte terapiens längd förlita sig som ett sätt att förutsäga den potentiella risken som förklaras av det första utslaget av ett utslag.
Även om godartade utslag också förekommer med armodafinil, är det inte möjligt att på ett tillförlitligt sätt förutsäga vilka utslag som kommer att visa sig vara allvarliga. Följaktligen bör armodafinil vanligtvis avbrytas vid det första tecknet på utslag, om inte utslaget uppenbarligen inte är läkemedelsrelaterat. Avbrott av behandlingen kan inte förhindra att ett utslag blir livshotande eller permanent inaktiverar eller desinficerar.
Angioödem och anafylaktoida reaktioner
Ett allvarligt fall av angioödem och ett fall av överkänslighet (med utslag, dysfagi och bronkospasm) observerades bland 1 955 patienter som behandlades med armodafinil. Patienter bör rådas att avbryta behandlingen och omedelbart rapportera till sin läkare några tecken eller symtom som tyder på angioödem eller anafylaxi (t.ex. svullnad i ansikte, ögon, läppar, tunga eller struphuvud; svårigheter att svälja eller andas; heshet).
Överkänslighetsreaktioner med flera organ
Flerorganers överkänslighetsreaktioner, inklusive minst en dödlighet efter marknadsföring, har haft inträffade i nära temporär associering (median tid för upptäckt 13 dagar: intervall 4-33) till inledningen av modafinil. En liknande risk för överorganisk överkänslighetsreaktioner med armodafinil kan inte uteslutas.
Även om det har funnits ett begränsat antal rapporter kan flerorganers överkänslighetsreaktioner leda till sjukhusinläggningar eller vara livshotande. Det finns inga faktorer som är kända för att förutsäga risken för förekomst eller svårighetsgraden av överkänslighetsreaktioner med flera organ som är associerade med modafinil. Tecken och symtom på denna störning var olika; patienter, men inte uteslutande, presenteras emellertid med feber och utslag i samband med andra organsysteminvolvering. Andra associerade manifestationer inkluderade myokardit, hepatit, abnormiteter i leverfunktionstest, hematologiska avvikelser (t.ex. eosinofili, leukopeni, trombocytopeni), klåda och asteni. Eftersom överkänslighet för flera organ är varierande i uttrycket, kan andra organsystemssymtom och tecken, som inte nämns här, förekomma.
Om man misstänker en överorganisk överkänslighetsreaktion bör NUVIGIL avbrytas. Även om det inte finns några fallrapporter som indikerar korskänslighet med andra läkemedel som producerar detta syndrom, erfarenheten av läkemedel som är förknippade med överorganisk överkänslighet för flera organ skulle indikera att detta är en möjlighet.
Ihållande sömnighet
Patienter med onormala sömnighetsnivåer som tar NUVIGIL bör informeras om att deras vakenhetsnivå kanske inte återgår till det normala. Patienter med överdriven sömnighet, inklusive de som tar NUVIGIL, bör ofta omprövas för deras grad av sömnighet och, om lämpligt, rekommenderas att undvika bilkörning eller annan potentiellt farlig aktivitet. Förskrivare bör också vara medvetna om att patienter kanske inte erkänner sömnighet eller dåsighet förrän de direkt ifrågasätts om dåsighet eller sömnighet under specifika aktiviteter.
Psykiatriska symtom
Psykiatriska biverkningar har rapporterats hos patienter som behandlats med modafinil. Modafinil och armodafinil (NUVIGIL) är mycket nära besläktade. Därför förväntas förekomsten och typen av psykiatriska symtom som är förknippade med armodafinil likna förekomsten och typen av dessa händelser med modafinil.
Biverkningar efter marknadsföring i samband med användning av modafinil har inkluderat mani, illusioner, hallucinationer, självmordstankar och aggression, vissa resulterade i sjukhusvistelse. Många, men inte alla, patienter hade en tidigare psykiatrisk historia. En frisk manlig volontär utvecklade idéer om referens, paranoida illusioner och hörsel hallucinationer i samband med flera dagliga 600 mg doser av modafinil och sömnberövning. Det fanns inga bevis på psykos 36 timmar efter avslutad läkemedel.
I den kontrollerade studien NUVIGIL-databasen var ångest, agitation, nervositet och irritabilitet orsaker till avbrytande av behandling ofta hos patienter på NUVIGIL jämfört med placebo (NUVIGIL 1,2% och placebo 0.3%). I de NUVIGIL-kontrollerade studierna var depression också ett skäl till att behandlingen avbröts oftare hos patienter på NUVIGIL jämfört med placebo (NUVIGIL 0,6% och placebo 0,2%). Två fall av självmordsidealisering observerades i kliniska prövningar. Försiktighet bör iakttas när NUVIGIL ges till patienter med en historia av psykos, depression eller mani. Om psykiatriska symtom utvecklas i samband med administrering av NUVIGIL, överväg att avbryta NUVIGIL.
topp
FÖRSIKTIGHETSÅTGÄRDER
Diagnostik av sömnstörningar
NUVIGIL ska endast användas till patienter som har gjort en fullständig utvärdering av deras överdrivna sömnighet, och i vilka a diagnos av antingen narkolepsi, OSAHS och / eller SWSD har gjorts i enlighet med ICSD- eller DSM-diagnostiska kriterier (se Kliniska tester). En sådan utvärdering består vanligtvis av en fullständig historik och fysisk undersökning, och den kan kompletteras med tester i laboratorieinställningar. Vissa patienter kan ha mer än en sömnstörning som bidrar till deras överdrivna sömnighet (t.ex. OSAHS och SWSD sammanfaller hos samma patient).
CPAP-användning för patienter med OSAHS
I OSAHS indikeras NUVIGIL som ett komplement till standardbehandling (er) för den underliggande hindringen. Om kontinuerligt positivt luftvägstryck (CPAP) är den behandling som valts för en patient, bör en maximal ansträngning behandlas med CPAP under en tillräcklig tidsperiod innan NUVIGIL påbörjas. Om NUVIGIL används tillsammans med CPAP, är uppmuntran till och periodisk bedömning av CPAP-efterlevnad nödvändig. Det fanns en liten trend för minskad CPAP-användning över tid (medelreduktion på 18 minuter för patienter som behandlades med NUVIGIL och en 6-minuters reduktion för placebobehandlade patienter från en genomsnittlig baslinjeanvändning på 6,9 timmar per natt) i NUVIGIL prövningar.
Allmän
Även om det inte har visats att NUVIGIL producerar funktionsnedsättning, kan något läkemedel som påverkar CNS förändra bedömning, tänkande eller motorisk färdighet. Patienter bör vara försiktiga med att använda en bil eller annan farlig maskin tills de är det rimligt säkert att NUVIGIL-terapi inte kommer att påverka deras förmåga att delta i sådant aktiviteter.
Kardiovaskulära systemet
NUVIGIL har inte utvärderats eller använts i någon märkbar utsträckning hos patienter som nyligen har haft hjärtinfarkt eller instabil angina, och sådana patienter bör behandlas med försiktighet.
I kliniska studier av PROVIGIL, tecken och symtom inklusive bröstsmärta, hjärtklappning, dyspné och kortvarig ischemi T-vågförändringar på EKG observerades hos tre försökspersoner i samband med mitralklappsprolaps eller vänster ventrikulär hypertrofi. Det rekommenderas att NUVIGIL-tabletter inte används till patienter med historik om vänster ventrikulär hypertrofi eller i patienter med mitral ventilprolaps som har upplevt mitralventil prolaps-syndrom när de tidigare fått CNS stimulantia. Tecken på mitralventil prolaps-syndrom inkluderar men är inte begränsade till ischemiska EKG-förändringar, bröstsmärta eller arytmi. Om ett nytt av dessa symtom inträffar, överväg hjärtutvärdering.
Blodtrycksmätning i kortvariga (â3 månader) kontrollerade studier visade endast små genomsnittliga ökningar i genomsnittligt systoliskt och diastoliskt blodtryck hos patienter som fick NUVIGIL jämfört med placebo (1,2 till 4,3 mmHg i de olika experimentella grupper). Det fanns också en något större andel patienter på NUVIGIL som krävde ny eller ökad användning av antihypertensiva läkemedel (2,9%) jämfört med patienter på placebo (1,8%). Ökad övervakning av blodtrycket kan vara lämpligt för patienter på NUVIGIL.
Patienter som använder steroida preventivmedel
Effekten av steroida preventivmedel kan minskas vid användning med NUVIGIL och under en månad efter avslutad behandling (se försiktighetsåtgärder, Läkemedelsinteraktioner). Alternativa eller samtidiga preventivmetoder rekommenderas för patienter som behandlas med NUVIGIL och under en månad efter avslutad behandling med NUVIGIL.
Patienter som använder Cyclosporine
Blodnivåerna av cyklosporin kan sänkas vid användning med NUVIGIL (se försiktighetsåtgärder, Läkemedelsinteraktioner). Övervakning av cirkulerande cyklosporinkoncentrationer och lämplig dosjustering för cyklosporin bör övervägas när dessa läkemedel används samtidigt.
Patienter med svårt nedsatt leverfunktion
Hos patienter med allvarligt nedsatt leverfunktion, med eller utan skrump (Se Klinisk farmakologi), NUVIGIL ska administreras i en reducerad dos (se Dosering och administrering).
Patienter med svårt nedsatt njurfunktion
Det finns otillräcklig information för att fastställa säkerheten och effekten av dosering hos patienter med allvarligt nedsatt njurfunktion (se farmakokinetik vid nedsatt njurfunktion, se Klinisk farmakologi).
Äldre patienter
Hos äldre patienter kan eliminering av armodafinil och dess metaboliter minskas till följd av åldrande. Därför bör hänsyn tas till användningen av lägre doser i denna population (se Klinisk farmakologi och Dosering och administrering).
Information för patienter
Läkare rekommenderas att diskutera följande problem med patienter för vilka de föreskriver NUVIGIL.
NUVIGIL är indicerat för patienter som har onormala sömnighetsnivåer. NUVIGIL har visat sig förbättra, men inte eliminera, denna onormala tendens att somna. Därför bör patienter inte ändra sitt tidigare beteende med avseende på potentiellt farliga aktiviteter (t.ex. körning, drift av maskiner) eller annat aktiviteter som kräver lämpliga nivåer av vakenhet, tills och om behandling med NUVIGIL inte har visat sig ge nivåer av vakenhet som tillåter sådan aktiviteter. Patienter bör informeras om att NUVIGIL inte ersätter sömn.
Patienter bör informeras om att det kan vara kritiskt att de fortsätter att ta sina tidigare föreskrivna behandlingar (t.ex. patienter med OSAHS som får CPAP bör fortsätta att göra det).
Patienter ska informeras om tillgängligheten av en patientinformationsbroschyr och de bör instrueras att läsa bipacksedeln innan de tar NUVIGIL. Se patientinformation i slutet av denna märkning för texten på broschyren som tillhandahålls för patienter.
Patienter bör rådas att kontakta sin läkare om de får utslag, depression, ångest eller tecken på psykos eller mani.
Graviditet
Patienter bör rådas att meddela sin läkare om de blir gravida eller avser att bli gravida under behandlingen. Patienter bör vara försiktiga när det gäller den potentiella ökade risken för graviditet vid användning av steroida preventivmedel (inklusive depå eller implanterbart) preventivmedel) med NUVIGIL och i en månad efter avslutad terapi (se Karcinogenes, mutagenes, nedsatt fertilitet och Graviditet).
Amning
Patienter bör informeras om att informera sin läkare om de ammar ett spädbarn.
Samtidig medicinering
Patienter bör rådas att informera sin läkare om de tar eller planerar att ta någon receptbelagda eller receptfria läkemedel, på grund av potentialen för interaktioner mellan NUVIGIL och andra droger.
Alkohol
Patienter bör informeras om att användningen av NUVIGIL i kombination med alkohol inte har studerats. Patienter bör informeras om att det är skonsamt att undvika alkohol medan du tar NUVIGIL.
Allergiska reaktioner
Patienter bör rådas att sluta ta NUVIGIL och meddela sin läkare om de utvecklar ett utslag, nässelfeber, munsår, blåsor, skalande hud, svårigheter att svälja eller andas eller en relaterad allergisk fenomen.
Läkemedelsinteraktioner
Potentiella interaktioner med läkemedel som hämmar, inducerar eller metaboliseras av Cytochrome P450 isoenzymer och andra leverenzymer
På grund av den partiella involveringen av CYP3A-enzymer i metabolisk eliminering av armodafinil, samtidigt administrering av potenta inducerare av CYP3A4 / 5 (t.ex. karbamazepin, fenobarbital, rifampin) eller hämmare av CYP3A4 / 5 (t.ex. ketokonazol, erytromycin) kan förändra plasmanivåerna för armodafinil.
Potentialen hos NUVIGIL att förändra metabolism av andra läkemedel genom enzyminduktion eller -inhibition
Läkemedel som metaboliseras av CYP1A2: In vitro-data visade att armodafinil visar ett svagt induktivt svar för CYP1A2 och eventuellt CYP3A aktiviteter på ett koncentrationsrelaterat sätt och visade att CYP2C19-aktivitet hämmas reversibelt av armodafinil. Effekten på CYP1A2-aktivitet observerades emellertid inte kliniskt i en interaktionsstudie utförd med koffein (se Klinisk farmakologi, Farmakokinetik, läkemedelsinteraktioner).
Läkemedel som metaboliseras av CYP3A4 / 5 (t.ex. cyklosporin, etinylöstradiol, midazolam och triazolam): Kronisk administration av NUVIGIL resulterade i måttlig induktion av CYP3A-aktivitet. Därför är effektiviteten för läkemedel som är substrat för CYP3A-enzymer (t.ex. cyklosporin, etinyl östradiol, midazolam och triazolam) kan minskas efter inledande av samtidig behandling med NUVIGIL. En minskning med 32% i systemisk exponering av oral midazolam sågs vid samtidig administrering av armodafinil och midazolam. Dosjustering kan behövas (se Klinisk farmakologi, Farmakokinetik, läkemedelsinteraktioner). Sådana effekter (reducerade koncentrationer) sågs också vid samtidig administrering av modafinil med cyklosporin, etinylöstradiol och triazolam.
Läkemedel som metaboliseras av CYP2C19 (t.ex. omeprazol, diazepam, fenytoin och propranolol): Administration av NUVIGIL resulterade i måttlig hämning av CYP2C19-aktivitet. Därför kan dosreduktion krävas för vissa läkemedel som är substrat för CYP2C19 (t.ex. fenytoin, diazepam och propranolol, omeprazol och klomipramin) när de används samtidigt med NUVIGIL. En exponering med 40% ökning sågs vid samtidig administrering av armodafinil och omeprazol. (Ser Klinisk farmakologi, Farmakokinetik, läkemedelsinteraktioner).
Interaktioner med CNS ACtive Drugs
Data specifika för interaktionspotential för armodafinil läkemedel med CNS-aktiva läkemedel finns inte tillgängliga. Följande tillgänglig information om läkemedelsinteraktion om modafinil bör dock vara tillämplig på armodafinil (se Beskrivning och Klinisk farmakologi).
Samtidig administrering av modafinil med metylfenidat eller dextroamfetamin gav inga signifikanta förändringar på farmakokinetisk profil för modafinil eller antingen stimulerande medel, även om absorptionen av modafinil försenades under ungefär en timme.
Samtidig modafinil eller klomipramin förändrade inte PK-profilen för varken läkemedel; emellertid rapporterades en incident av ökade nivåer av klomipramin och dess aktiva metabolit desmetylklomipramin hos en patient med narkolepsi under behandling med modafinil.
Data specifika för armodafinil eller modafinil läkemedelsinteraktionspotential med Monoamine Oxidase (MAO) -hämmare är inte tillgängliga. Därför bör försiktighet vidtas vid samtidig administrering av MAO-hämmare och NUVIGIL.
Interaktioner med andra droger
Data specifika för potentialen för interaktioner mellan läkemedel och läkemedel för andra läkemedel är inte tillgängliga Följande tillgänglig information om läkemedelsinteraktion om modafinil bör dock vara tillämplig på armodafinil.
warfarin - Samtidig administrering av modafinil och warfarin gav inte signifikanta förändringar i de farmakokinetiska profilerna för R- och S-warfarin. Eftersom bara en enda dos warfarin testades i denna studie, kan en farmakodynamisk interaktion inte uteslutas. Därför bör mer frekvent övervakning av protrombintider / INR övervägas när NUVIGIL administreras samtidigt med warfarin.
Karcinogenes, mutagenes, nedsatt fertilitet
Karcinogenicitet
Karcinogenicitetsstudier har inte utförts med enbart armodafinil. Karcinogenicitetsstudier genomfördes där modafinil administrerades i kosten till möss under 78 veckor och till råttor under 104 veckor i doser av 6, 30 och 60 mg / kg / dag. Den högsta studerade dosen representerar 1,5 (mus) eller 3 (råtta) gånger högre än den rekommenderade dagliga dosen av modafinil (200 mg) för vuxna på en mg / m2-bas. Det fanns inga bevis för tumörgenes associerad med modafinil-administration i dessa studier. Eftersom musstudien använde en otillräcklig hög dos som inte var representativ för en maximalt tolererad dos, genomfördes en efterföljande karcinogenicitetsstudie i Tg. AC-transgen mus. Doser utvärderade i Tg. AC-analys var 125, 250 och 500 mg / kg / dag, administrerad dermalt. Det fanns inga bevis på tumörgenicitet associerad med modafinil-administration; emellertid kanske denna hudmodell inte tillräckligt bedömer den karcinogena potentialen hos ett oralt administrerat läkemedel.
mutagenes
Armodafinil utvärderades i en in vitro bakteriell omvänd mutationsanalys och i en in vitro kromosomal aberreringsanalys hos däggdjur i humana lymfocyter. Armodafinil var negativ i dessa analyser, både i frånvaro och närvaro av metabolisk aktivering.
Modafinil visade inga bevis på mutagen eller potentiell potential i en serie in vitro (dvs. bakteriell omvänd mutationsanalys, muslymfom-tk-analys, kromosomavvikelse analys i humana lymfocyter, celltransformationsanalys i BALB / 3T3-musembryoceller) analyser i frånvaro eller närvaro av metabolisk aktivering, eller in vivo (musbenmärgsmikronukleus) analyser. Modafinil var också negativt vid den oplanerade DNA-syntesanalysen i hepatocyter från råtta.
Försämring av fertilitet
En fertilitetsstudie och tidig embryonal utvecklingsstudie (till implantation) genomfördes inte med endast armodafinil.
Oral administrering av modafinil (doser upp till 480 mg / kg / dag) till hanråttor och honråttor före och genom hela parning, och fortsätter hos kvinnor genom graviditetsdag 7 gav en ökning av tiden för att para sig som högst dos; inga effekter observerades på andra fertilitets- eller reproduktionsparametrar. Ingen effektdosen på 240 mg / kg / dag var associerad med en plasmamodafinil-exponering (AUC) ungefär lika stor som hos människor vid den rekommenderade dosen på 200 mg.
Graviditet
Graviditet kategori C.
I studier utförda på råttor (armodafinil, modafinil) och kaniner (modafinil) observerades utvecklingstoxicitet vid kliniskt relevant exponering.
Oral administrering av armodafinil (60, 200 eller 600 mg / kg / dag) till gravida råttor under hela organogenesperioden resulterade i ökad incidenser av fetala viscerala och skelettvariationer i den mellanliggande dosen eller större och minskade fetala kroppsvikt vid högsta dos. Ingen effektdos för embryofetal utvecklingstoxicitet hos råtta var associerad med en plasma-armodafinil exponering (AUC) ungefär 0,03 gånger AUC hos människor vid den maximala rekommenderade dagliga dosen på 250 mg.
Modafinil (50, 100 eller 200 mg / kg / dag) administrerat oralt till gravida råttor under hela organogenesperioden orsakad, i frånvaro av maternell toxicitet, en ökning av resorptioner och en ökad förekomst av viscerala och skelettvariationer i avkomman som högst dos. Den högre dosen utan effekt för embryofetaltoxicitet hos råtta var associerad med en plasma modafinil exponering ungefär 0,5 gånger AUC hos människor i den rekommenderade dagliga dosen (RHD) av 200 mg I en efterföljande studie på upp till 480 mg / kg / dag (plasmamodafinil exponering ungefär 2 gånger AUC hos människor vid RHD) observerades inga negativa effekter på embryofetaltillväxt.
Modafinil administreras oralt till gravida kaniner under hela organogenesperioden i doser upp till 100 mg / kg / dag (plasma-modafinil AUC ungefär lika med AUC hos människor vid RHD) hade ingen effekt på embryofetal utveckling; doserna som användes var emellertid för låga för att adekvat bedöma effekterna av modafinil på embryofetalutvecklingen. I en efterföljande utvecklingstoxicitetsstudie utvärderades doser på 45, 90 och 180 mg / kg / dag under graviditet kaniner, förekomsten av fosterets strukturella förändringar och embryofetaldöd ökade högst dos. Den högsta dosen utan effekt för utvecklingstoxicitet var associerad med en plasma-modafinil AUC ungefär lika med AUC hos människor vid RHD.
Modafinil-administration till råttor under hela graviditeten och amning vid orala doser upp till 200 mg / kg / dag resulterade i minskad livskraft hos avkomman vid doser större än 20 mg / kg / dag (plasma-modafinil AUC ungefär 0,1 gånger AUC hos människor vid RHD). Inga effekter på postnatal utvecklings- och neurobevektionsparametrar observerades hos överlevande avkommor.
Det finns inga adekvata och välkontrollerade studier av varken armodafinil eller modafinil på gravida kvinnor. Två fall av intrauterin tillväxtfördröjning och ett fall av spontan abort har rapporterats i samband med armodafinil och modafinil. Även om farmakologin för armodafinil inte är identisk med den för de sympatomimetiska aminerna, delar den vissa farmakologiska egenskaper med denna klass. Vissa av dessa läkemedel har associerats med intrauterin tillväxtfördröjning och spontana aborter. Huruvida de fall som rapporterats med armodafinil är läkemedelsrelaterade är okänt.
Armodafinil eller modafinil ska endast användas under graviditet om den potentiella nyttan motiverar den potentiella risken för fostret.
Arbetskraft och leverans
Effekten av armodafinil på förlossning och leverans hos människor har inte undersökts systematiskt.
Ammande mödrar
Det är inte känt om armodafinil eller dess metaboliter utsöndras i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk bör försiktighet iakttas när NUVIGIL-tabletter ges till en ammande kvinna.
Pediatrisk användning
Säkerhet och effektivitet vid användning av armodafinil hos individer under 17 år har inte fastställts. Allvarliga utslag har observerats hos barn som fick modafinil
Geiratric användning
Säkerhet och effektivitet hos personer över 65 år har inte fastställts.
topp
Negativa reaktioner
Armodafinil har utvärderats för säkerhet hos över 1100 patienter med överdriven sömnighet i samband med primära sömnstörningar och vakenhet. I kliniska studier har NUVIGIL visat sig vara allmänt väl tolererat och de flesta biverkningar var milt till måttligt.
I de placebokontrollerade kliniska studierna var de vanligaste observerade biverkningarna (5%) förknippade med användningen av NUVIGIL som förekom oftare än hos de placebobehandlade patienterna var huvudvärk, illamående, yrsel och sömnlöshet. Profilen för biverkningar var liknande i studierna.
I de placebokontrollerade kliniska studierna avbröts 44 av de 645 patienterna (7%) som fick NUVIGIL på grund av en biverkning jämfört med 16 av de 445 (4%) patienterna som fick placebo. Det vanligaste skälet till avbrott var huvudvärk (1%).
Insidens i kontrollerade försök
Följande tabell (tabell 3) visar de negativa upplevelserna som inträffade med en hastighet av 1% eller mer och var mer ofta hos patienter som behandlats med NUVIGIL än hos placebogrupper i de placebokontrollerade kliniska studierna.
Förskrivaren bör vara medveten om att siffrorna som anges nedan inte kan användas för att förutsäga frekvensen av negativa upplevelser i genom vanlig medicinsk praxis, där patientens egenskaper och andra faktorer kan skilja sig från de som uppstår under kliniska studier. På liknande sätt kan de angivna frekvenserna inte direkt jämföras med siffror erhållna från andra kliniska undersökningar som involverar olika behandlingar, användningar eller utredare. Genomgång av dessa frekvenser ger emellertid förskrivare en grund för att uppskatta det relativa bidraget från läkemedels- och icke-läkemedelsfaktorer till förekomsten av biverkningar i den studerade befolkningen.
| Systemorgelklass MedDRA-föredragen term |
Nuvigil (Procent, N = 645) |
Placebo (Procent, N = 445) |
ª Fyra dubbelblinda, placebokontrollerade kliniska studier på SWSD, OSAHS och narkolepsi; förekomsten avrundas till närmaste hela procent. Inkluderade är endast de händelser för vilka Nuvigil-incidensen är större än placebo. | ||
| Hjärtproblem | ||
| hjärtklappning | 2 | 1 |
| Gastrointestinala störningar | ||
| Illamående | 7 | 3 |
| Diarre | 4 | 2 |
| Torr mun | 4 | 1 |
| Dyspepsi | 2 | 0 |
| Buksmärta övre | 2 | 1 |
| Förstoppning | 1 | 0 |
| kräkningar | 1 | 0 |
| Lös avföring | 1 | 0 |
| Allmänna störningar och administrationssituationer | ||
| Trötthet | 2 | 1 |
| Törst | 1 | 0 |
| Influensaliknande sjukdom | 1 | 0 |
| Smärta | 1 | 0 |
| feber | 1 | 0 |
| Immunsystemstörningar | ||
| Säsongsallergi | 1 | 0 |
| undersökningar | ||
| Gamma-glutamyltransferas ökat | 1 | 0 |
| Hjärtfrekvensen ökade | 1 | 0 |
| Metabolism och näringsstörningar | ||
| Anorexi | 1 | 0 |
| Minskad aptit | 1 | 0 |
| Nervsystemet | ||
| Huvudvärk | 17 | 9 |
| Yrsel | 5 | 2 |
| Störning i uppmärksamhet | 1 | 0 |
| Darrning | 1 | 0 |
| Migrän | 1 | 0 |
| Paraesthia | 1 | 0 |
| Psykiatriska störningar | ||
| Sömnlöshet | 5 | 1 |
| Ångest | 4 | 1 |
| Depression | 2 | 0 |
| Agitation | 1 | 0 |
| Nervositet | 1 | 0 |
| Deppigt humör | 1 | 0 |
| Njur- och urinproblem | ||
| polyuri | 1 | 0 |
| Andningsstörningar, toraksyra och mediastinum | ||
| dyspné | 1 | 0 |
| Hud- och subkutana vävnadsstörningar | ||
| Utslag | 2 | 0 |
| Kontaktdermatit | 1 | 0 |
| hyperhidros | 1 | 0 |
Dosberoende av biverkningar
I de placebokontrollerade kliniska studierna som jämförde doser på 150 mg / dag och 250 mg / dag av Nuvigil och placebo, de enda biverkningarna som tycktes vara dosrelaterade var huvudvärk, utslag, depression, munorrhet, sömnlöshet och illamående.
ª Fyra dubbelblinda, placebokontrollerade kliniska studier på SWSD, OSAHS och narkolepsi. | ||||
| Systemorgelklass MedDRA-föredragen term |
Nuvigil 250 mg (Procent, N = 198) |
Nuvigil 150 mg (Procent, N = 447) |
Nuvigil Kombinerad (Procent, N = 645) |
Placebo (Procent, N = 445) |
|---|---|---|---|---|
| Gastrointestinala störningar | ||||
| Illamående | 9 | 6 | 7 | 3 |
| Torr mun | 7 | 2 | 4 | <1 |
| Nervsystemet | ||||
| Huvudvärk | 23 | 14 | 17 | 9 |
| Psykiatriska störningar | ||||
| Sömnlöshet | 6 | 4 | 5 | 1 |
| Depression | 3 | 1 | 2 | <1 |
| Hud- och subkutana vävnadsstörningar | ||||
| Utslag | 4 | 1 | 2 | <1 |
Vitala teckenändringar
Det var små, men konsekventa, ökningar i medelvärden för genomsnittligt systoliskt och diastoliskt blodtryck i kontrollerade studier (se försiktighetsåtgärder). Det var en liten, men konsekvent, genomsnittlig ökning i pulsfrekvens jämfört med placebo i kontrollerade studier. Denna ökning varierade från 0,9 till 3,5 BPM.
Laboratorieändringar
Parametrarna för klinisk kemi, hematologi och urinalys övervakades i studierna. Genomsnittliga plasmanivåer av gamma glutamyltransferas (GGT) och alkaliskt fosfatas (AP) visade sig vara högre efter administrering av NUVIGIL, men inte placebo. Några försökspersoner hade dock GGT- eller AP-höjder utanför det normala intervallet. Inga skillnader var synliga i alaninaminotransferas, aspartataminotransferas, totalt protein, albumin, eller totalt bilirubin, även om det fanns sällsynta fall av isolerade förhöjningar av AST och / eller ALT. Ett enda fall av mild pancytopeni observerades efter 35-dagars behandling och löstes med läkemedelsavbrott. En liten genomsnittlig minskning från baslinjen i serum urinsyra jämfört med placebo sågs i kliniska studier. Den kliniska betydelsen av detta fynd är okänd.
EKG-förändringar
Inget mönster av EKG-abnormiteter kunde tillskrivas NUVIGIL-administrering i placebokontrollerade kliniska studier.
topp
Drogmissbruk och beroende
Kontrollerad ämnesklass
Armodafinil (NUVIGIL) är ett schema IV-kontrollerat ämne.
Missbruk av potential och beroende
Även om missbrukspotentialen för armodafinil inte har studerats specifikt, är dess missbrukspotential sannolikt lik den för modafinil (PROVIGIL). Hos människor ger modafinil psykoaktiva och euforiska effekter, förändringar i humör, uppfattning, tänkande och känslor som är typiska för andra CNS-stimulanser. I in vitro-bindningsstudier binder modafinil till dopaminåterupptagningsstället och orsakar en ökning av extracellulär dopamin, men ingen ökning i dopaminfrisättning. Modafinil förstärker, vilket framgår av dess självadministrering hos apor som tidigare utbildats för att själv administrera kokain. I vissa studier diskriminerades modafinil också delvis som stimulerande. Läkare bör följa patienter noga, särskilt de som har haft drogmissbruk och / eller stimulerande medel (t.ex. metylfenidat, amfetamin eller kokain). Patienter bör observeras för tecken på missbruk eller missbruk (t.ex. ökning av doser eller läkemedelssökande beteende).
Missbrukspotentialen för modafinil (200, 400 och 800 mg) bedömdes i förhållande till metylfenidat (45 och 90 mg) i en slutenvårdsstudie hos individer med erfarenhet av missbruk. Resultaten från den kliniska studien visade att modafinil gav psykoaktiva och euforiska effekter och känslor i överensstämmelse med andra schemalagda CNS-stimulanter (metylfenidat).
topp
Överdos
Mänsklig erfarenhet
Det rapporterades inga överdoser i de kliniska studierna NUVIGIL. Symtom på överdos av NUVIGIL kommer sannolikt att likna modafinil. Överdosering i kliniska studier av modafinil inkluderade excitation eller agitation, sömnlöshet och svaga eller måttliga förhöjningar i hemodynamiska parametrar. Från erfarenhet av marknadsföring med modafinil har det inte rapporterats några dödliga överdoser med modafinil enbart (doser upp till 12 gram). Överdoser med flera läkemedel, inklusive modafinil, har lett till dödliga resultat. Symtom som ofta följer med överdosering av modafinil, ensam eller i kombination med andra läkemedel har inkluderat; sömnlöshet; symptom i centrala nervsystemet såsom rastlöshet, desorientering, förvirring, upphetsning och hallucination; matsmältningsförändringar såsom illamående och diarré; och kardiovaskulära förändringar såsom takykardi, bradykardi, hypertoni och bröstsmärta.
Hantering av överdosering
Det finns ingen specifik motgift för de toxiska effekterna av en överdos av NUVIGIL. Sådana överdoser bör hanteras med främst stödjande vård, inklusive kardiovaskulär övervakning. Om det inte finns några kontraindikationer, bör inducerad emes eller gastrisk sköljning övervägas. Det finns inga data som tyder på användningen av dialys eller urinsurning eller alkalinisering för att förbättra läkemedels eliminering. Läkaren bör överväga att kontakta ett giftkontrollcenter för rådgivning vid behandling av överdosering.
topp
Dosering och administrering
Obstruktiv sömnapné / hypopneasyndrom (OSAHS) och narkolepsi
Den rekommenderade dosen NUVIGIL för patienter med OSAHS eller narkolepsi är 150 mg eller 250 mg som ges som en enda dos på morgonen. Hos patienter med OSAHS har doser upp till 250 mg / dag, ges som en enda dos, tolererats väl, men där är inget konsekvent bevis på att denna dos ger ytterligare fördelar utöver 150 mg / dagsdosen (se Klinisk farmakologi och Kliniska tester).
Shift Work Sleep Disorder (SWSD)
Den rekommenderade dosen NUVIGIL för patienter med SWSD är 150 mg som ges dagligen ungefär 1 timme innan arbetsskiftet påbörjas.
Dosjustering bör övervägas för samtidig medicinering som är substrat för CYP3A4 / 5, såsom steroida preventivmedel, triazolam och cyklosporin (se FÖRSIKTIGHETSÅTGÄRDER, läkemedelsinteraktioner).
Läkemedel som till stor del elimineras via CYP2C19-metabolism, såsom diazepam, propranolol och fenytoin kan ha långvarig eliminering vid samtidig administrering med NUVIGIL och kan kräva dosdosering och övervakning av toxicitet (Ser försiktighetsåtgärder, Läkemedelsinteraktioner).
Hos patienter med allvarligt nedsatt leverfunktion ska NUVIGIL administreras i en reducerad dos (se avsnitt 1) Klinisk farmakologi och försiktighetsåtgärder).
Det finns otillräcklig information för att fastställa säkerheten och effekten av doseringen hos patienter med allvarligt nedsatt njurfunktion (se Klinisk farmakologi och försiktighetsåtgärder).
Hos äldre patienter kan eliminering av armodafinil och dess metaboliter minskas till följd av åldrande. Därför bör hänsyn tas till användningen av lägre doser i denna population (se Klinisk farmakologi och försiktighetsåtgärder).
topp
Hur levereras / lagring och hantering
Nuvigil® (armodafinil) tabletter [C-IV]
50 mg: Varje rund, vit till benvit tablett präglas av  på ena sidan och "205" på den andra.
på ena sidan och "205" på den andra.
NDC 63459-205-60 - Flaskor på 60
150 mg: Varje oval vit till benvit tablett präglas av  på ena sidan och "215" på den andra.
på ena sidan och "215" på den andra.
NDC 63459-215-60 - Flaskor på 60
250 mg: Varje oval vit till benvit tablett präglas av  på ena sidan och "225" på den andra.
på ena sidan och "225" på den andra.
NDC 63459-225-60 - Flaskor på 60
Förvaras vid 20 ° - 25 ° C (68 ° - 77 ° F).
Tillverkad för:
Cephalon, Inc.
Frazer, PA 19355
senast uppdaterad 02/2010
Nuvigil patientinformationsblad (på vanligt engelska)
Detaljerad information om Tecken, symtom, orsaker, behandling av sömnstörningar
Informationen i denna monografi är inte avsedd att täcka alla möjliga användningar, anvisningar, försiktighetsåtgärder, läkemedelsinteraktioner eller negativa effekter. Denna information är generaliserad och är inte avsedd som specifik medicinsk rådgivning. Om du har frågor om läkemedlen du tar eller vill ha mer information, kontakta din läkare, apotekspersonal eller sjuksköterska.
tillbaka till:
~ alla artiklar om sömnstörningar



