Apidra för behandling av diabetes
Varumärke: Apidra
Generiskt namn: Insulin glulisin
Apidra (insulin glulisine) är en konstgjord produkt nästan identisk med humant insulin. Det används för att behandla diabetes mellitus. Användning, dosering, biverkningar.
Innehåll:
Indikationer och användning
Dosering och administrering
Kontra
Varningar och försiktighetsåtgärder
Negativa reaktioner
Läkemedelsinteraktioner
Användning i specifika befolkningar
överdosering
Beskrivning
Klinisk farmakologi
Icke-klinisk toxikologi
Kliniska studier
Hur levereras
Apidra, insulin glusine, patientinformation (på vanligt engelska)
indikationer
Apidra är en snabbverkande humaninsulinanalog som är indicerad för att förbättra glykemisk kontroll hos vuxna och barn med diabetes mellitus.
topp
Dosering och administrering
Doseringshänsyn
APIDRA är en rekombinant insulinanalog som är ekvipotent för humant insulin (dvs. en enhet av APIDRA har samma glukos-sänkande effekt som en enhet vanligt humant insulin) när det ges intravenöst. När det ges subkutant har APIDRA en snabbare effekt och en kortare verkningstid än vanligt humant insulin.
Dosen av APIDRA måste individualiseras. Blodglukosövervakning är avgörande för alla patienter som får insulinbehandling.
Det totala dagliga insulinbehovet kan variera och är vanligtvis mellan 0,5 till 1 enhet / kg / dag. Insulinbehov kan förändras under stress, allvarlig sjukdom eller med förändringar i träning, måltidsmönster eller administrerade läkemedel samtidigt.
Subkutan administration
APIDRA ska ges inom 15 minuter före en måltid eller inom 20 minuter efter att måltiden påbörjats.
APIDRA ges genom subkutan injektion bör i allmänhet användas i regimer med ett mellanliggande eller långverkande insulin.
APIDRA ska administreras genom subkutan injektion i bukväggen, låret eller överarmen. Injektionsställen bör roteras inom samma region (buken, låret eller överarmen) från en injektion till nästa för att minska risken för lipodystrofi [Se NEGATIVA REAKTIONER].
Kontinuerlig subkutan infusion (insulinpump)
APIDRA kan administreras genom kontinuerlig subkutan infusion i bukväggen. Använd inte utspädda eller blandade insuliner i externa insulinpumpar. Infusionsställen bör roteras inom samma region för att minska risken för lipodystrofi [Se NEGATIVA REAKTIONER]. Den initiala programmeringen av den externa insulininfusionspumpen bör baseras på den totala dagliga insulindosen från föregående behandling.
Följande insulinpumpar har använts i kliniska studier av APIDRA genomförda av sanofi-aventis, tillverkaren av APIDRA:
- Disetronic® H-Tron® plus V100 och D-Tron® med Disetronic-katetrar (Rapid ™, Rapid C ™, Rapid D ™ och Tender ™)
- MiniMed®-modeller 506, 507, 507c och 508 med MiniMed-katetrar (Sof-set Ultimate QR ™ och Quick-set ™).
Innan du använder en annan insulinpump med APIDRA, läs pumpens etikett för att se till att pumpen har utvärderats med APIDRA.
Läkare och patienter bör noggrant utvärdera information om pumpanvändning i APIDRA-föreskrivande information, Patientinformationsbroschyr och pumptillverkarens handbok. APIDRA-specifik information bör följas för användningstid, frekvens för att byta infusionssatser eller annat detaljer specifika för APIDRA-användning, eftersom APIDRA-specifik information kan skilja sig från den allmänna pumpmanualen instruktioner.
Baserat på in vitro-studier som har visat förlust av konserveringsmedel, metakresol och insulinnedbrytning, bör APIDRA i behållaren ändras minst var 48: e timme. APIDRA vid klinisk användning ska inte utsättas för temperaturer högre än 37 ° C. [Ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och HUR LEVERANDE / Lagring och hantering].
Intravenös administration
APIDRA kan administreras intravenöst under medicinsk övervakning för glykemisk kontroll med noggrann övervakning av blodglukos och serumkalium för att undvika hypoglykemi och hypokalemi. För intravenös användning ska APIDRA användas i koncentrationer av 0,05 enheter / ml till 1 enhet / ml insulin glulisin i infusionssystem med polyvinylklorid (PVC) påsar. APIDRA har visat sig vara stabilt endast i normal saltlösning (0,9% natriumklorid). Parenterala läkemedelsprodukter bör inspekteras visuellt med avseende på partiklar och missfärgning före administrering, när lösning och behållare tillåter. Administrera inte insulinblandningar intravenöst.
Doseringsformer och styrkor
Apidra 100 enheter per ml (U-100) är tillgängligt som:
- 10 ml injektionsflaskor
- 3 ml patroner för användning i OptiClik® Insulinleveransenhet
- 3 ml SoloStar förfylld penna
topp
Kontra
Apidra är kontraindicerat:
- under avsnitt av hypoglykemi
- hos patienter som är överkänsliga mot Apidra eller mot något av dess hjälpämnen
När de används till patienter med känd överkänslighet mot Apidra eller dess hjälpämnen, kan patienter utveckla lokala eller generaliserade överkänslighetsreaktioner [Se Negativa reaktioner].
topp
Varningar och försiktighetsåtgärder
Dosjustering och övervakning
Glukosövervakning är nödvändig för patienter som får insulinbehandling. Ändringar av en insulinregim bör göras försiktigt och endast under medicinsk övervakning. Förändringar i insulinstyrka, tillverkare, typ eller administreringssätt kan leda till att insulindosen ändras. Samtidig oral antidiabetisk behandling kan behöva justeras.
Liksom med alla insulinpreparat kan Apidra: s verkningstid variera mellan olika individer eller vid olika tidpunkter i samma person och är beroende av många tillstånd, inklusive injektionsstället, lokal blodtillförsel eller lokal temperatur. Patienter som ändrar sin fysiska aktivitet eller måltidsplan kan behöva justera insulindoserna.
hypoglykemi
Hypoglykemi är den vanligaste biverkningen av insulinbehandling, inklusive Apidra. Risken för hypoglykemi ökar med stramare glykemisk kontroll. Patienter måste utbildas att känna igen och hantera hypoglykemi. Svår hypoglykemi kan leda till medvetslöshet och / eller kramper och kan leda till tillfällig eller permanent nedsatt hjärnfunktion eller död. Svår hypoglykemi som kräver hjälp av en annan person och / eller parenteral glukosinfusion eller glukagonadministrering har observerats i kliniska studier med insulin, inklusive studier med Apidra.
Tidpunkten för hypoglykemi återspeglar vanligtvis tid-verkningsprofilen för de administrerade insulinformuleringarna. Andra faktorer som förändringar i matintag (t.ex. mängd mat eller måltider), injektionsställe, träning och samtidig medicinering kan också förändra risken för hypoglykemi [Se Läkemedelsinteraktioner].
Som med alla insuliner ska du vara försiktig hos patienter med hypoglykemi-medvetenhet och hos patienter som kan vara det predisponerad för hypoglykemi (t.ex. den pediatriska populationen och patienter som fastar eller har oberoende mat intag). Patientens förmåga att koncentrera sig och reagera kan försämras till följd av hypoglykemi. Detta kan utgöra en risk i situationer där dessa förmågor är särskilt viktiga, till exempel att köra eller använda andra maskiner.
Snabba förändringar i serumglukosnivåer kan orsaka symtom som liknar hypoglykemi hos personer med diabetes, oavsett glukosvärde. Tidiga varningssymptom på hypoglykemi kan vara olika eller mindre uttalade under vissa förhållanden, såsom långvarig diabetes, nervsjukdom hos diabetiker, användning av mediciner som betablockerare [Se Läkemedelsinteraktioner], eller intensifierad diabeteskontroll. Dessa situationer kan leda till svår hypoglykemi (och möjligen förlust av medvetande) innan patientens medvetenhet om hypoglykemi.
Intravenöst administrerat insulin har en snabbare effekt än subkutant administrerat insulin, vilket kräver närmare övervakning av hypoglykemi.
Överkänslighet och allergiska reaktioner
Allvarlig, livshotande, generaliserad allergi, inklusive anafylax, kan uppstå med insulinprodukter, inklusive Apidra [Se Negativa reaktioner].
hypokalemi
Alla insulinprodukter, inklusive Apidra, orsakar en förskjutning av kalium från det extracellulära till det intracellulära utrymmet, vilket kan leda till hypokalemi. Obehandlad hypokalemi kan orsaka andningsförlamning, ventrikulär arytmi och död. Var försiktig hos patienter som kan vara i riskzonen för hypokalemi (t.ex. patienter som använder kaliumsänkande läkemedel, patienter som tar mediciner känsliga för serumkaliumkoncentrationer). Övervaka glukos och kalium ofta när Apidra administreras intravenöst.
Nedsatt njur- eller leverfunktion
Frekvent övervakning av glukos och minskning av insulindos kan behövas hos patienter med nedsatt njur- eller leverfunktion [Se Klinisk farmakologi].
Blandning av insuliner
Apidra för subkutan injektion ska inte blandas med andra insulinpreparat än NPH-insulin. Om Apidra blandas med NPH-insulin, ska Apidra dras in i sprutan först. Injektion ska ske omedelbart efter blandning.
Blanda inte Apidra med andra insuliner för intravenös administrering eller för användning i en kontinuerlig subkutan infusionspump.
Apidra för intravenös administrering ska inte spädas med andra lösningar än 0,9% natriumklorid (normal saltlösning). Effekten och säkerheten för att blanda Apidra med utspädningsmedel eller andra insuliner för användning i externa subkutana infusionspumpar har inte fastställts.
Subkutan insulininfusionspumpar
Vid användning i en extern insulinpump för subkutan infusion ska Apidra inte spädas eller blandas med något annat insulin. Apidra i behållaren bör bytas minst var 48: e timme. Apidra ska inte utsättas för temperaturer högre än 37 ° C.
Fel på insulinpumpen eller infusionssetet eller nedbrytning av insulin kan snabbt leda till hyperglykemi och ketos. Snabb identifiering och korrigering av orsaken till hyperglykemi eller ketos är nödvändig. Interkutana subkutana injektioner med Apidra kan behövas. Patienter som använder kontinuerlig subkutan insulininfusionspumpsterapi måste utbildas för att administrera insulin genom injektion och ha alternativ insulinbehandling tillgänglig vid pumpfel. [Ser Dosering och administrering, Hur levereras / lagring och hantering].
Intravenös administration
När Apidra administreras intravenöst måste glukos- och kaliumnivåer övervakas noggrant för att undvika potentiellt dödlig hypoglykemi och hypokalemi.
Blanda inte Apidra med andra insuliner för intravenös administrering. Apidra får endast spädas i normal saltlösning.
Läkemedelsinteraktioner
Vissa mediciner kan förändra insulinbehovet och risken för hypoglykemi eller hyperglykemi [Se Läkemedelsinteraktioner].
topp
Negativa reaktioner
Följande biverkningar diskuteras någon annanstans:
- Hypoglykemi [Se Varningar och försiktighetsåtgärder]
- Hypokalemi [Se Varningar och försiktighetsåtgärder]
Erfarenhet av klinisk prövning
Eftersom kliniska prövningar utförs under mycket varierande konstruktioner, kanske biverkningsgraden som rapporterats i en klinisk studie inte kan lätt jämföras med de hastigheter som rapporterats i en annan klinisk prövning och kanske inte återspeglar de hastigheter som faktiskt observerats i kliniska öva.
Frekvensen av biverkningar under de kliniska studierna av Apidra hos patienter med typ 1-diabetes mellitus och typ 2-diabetes mellitus listas i tabellerna nedan.
Tabell 1: Behandling - biverkningar av sammansatta medel i sammanslagna studier av vuxna med typ 1-diabetes (biverkningar med frekvens - 5%)
| APIDRA,% (N = 950) |
Alla jämförareen, % (N = 641) |
|
| nasofaryngit | 10.6 | 12.9 |
| hypoglykemib | 6.8 | 6.7 |
| Övre luftvägsinfektion | 6.6 | 5.6 |
| Influensa | 4.0 | 5.0 |
|
en Insulin lispro, vanlig humant insulin, insulin aspart b Endast svår symtomatisk hypoglykemi |
Tabell 2: Behandling - biverkningar av sammansatta medel i poolade studier av vuxna med typ 2-diabetes (biverkningar med frekvens - 5%)
| APIDRA,% (N = 883) |
Vanligt humant insulin,% (N = 883) |
|
| Övre luftvägsinfektion | 10.5 | 7.7 |
| nasofaryngit | 7.6 | 8.2 |
| Perifert ödem | 7.5 | 7.8 |
| Influensa | 6.2 | 4.2 |
| artralgi | 5.9 | 6.3 |
| hypertension | 3.9 | 5. |
- Pediatrik
Tabell 3 sammanfattar biverkningarna som inträffade med en frekvens högre än 5% i en klinisk studie hos barn och ungdomar med typ 1-diabetes behandlad med APIDRA (n = 277) eller insulin lispro (N = 295).
Tabell 3: Behandling - biverkningar avergent hos barn och ungdomar med typ 1-diabetes (biverkningar med frekvens â ¥ ¥ 5%)
| APIDRA,% (N = 277) |
Lispro,% (N = 295) |
|
| nasofaryngit | 9.0 | 9.5 |
| Övre luftvägsinfektion | 8.3 | 10.8 |
| Huvudvärk | 6.9 | 11.2 |
| Hypoglykemiskt anfall | 6.1 | 4.7 |
- Allvarlig symptomatisk hypoglykemi
Hypoglykemi är den vanligaste biverkningen hos patienter som använder insulin, inklusive Apidra [Se Varningar och försiktighetsåtgärder]. Hastigheterna och förekomsten av svår symtomatisk hypoglykemi, definierad som hypoglykemi som kräver intervention från en tredje part, var jämförbara för alla behandlingsregimer (se tabell 4). I den kliniska fas 3-studien hade barn och ungdomar med diabetes typ 1 högre incidens av svår symtomatisk hypoglykemi i de två behandlingsgrupperna jämfört med vuxna med typ 1 diabetes. (se tabell 4) [Se Kliniska studier].
Tabell 4: Svår symtomatisk hypoglykemi *
| Diabetes typ 1 vuxna 12 veckor med insulin glargin |
Diabetes vuxna av typ 1 26 veckor med insulin glargin |
Diabetes typ 2 vuxna 26 veckor med NPH humant insulin |
Typ 1 Diabetes Pediatrics 26 veckor |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Pre-meal |
Apidra Post-måltid |
Vanligt humant insulin | Apidra | Insulin Lispro | Apidra | Vanligt humant insulin | Apidra | Insulin Lispr | |
| * Allvarlig symtomatisk hypoglykemi definierad som en hypoglykemisk händelse som kräver hjälp av en annan person som uppfyllde ett av följande kriterier: händelsen var förknippad med ett helblod refererat till blodglukos <36 mg / dL eller händelsen var associerad med snabb återhämtning efter oral kolhydrat, intravenös glukos eller glukagonadministrering. | |||||||||
| Händelser per månad per patient | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Procent av patienter (n / total N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Insulininitiering och intensifiering av glukoskontroll
Intensifiering eller snabb förbättring av glukoskontroll har associerats med en övergående, reversibel oftalmologisk refraktionsstörning, förvärrad diabetisk retinopati och akut smärtsam perifer neuropati. Långsiktig glykemisk kontroll minskar dock risken för diabetisk retinopati och neuropati.
- lipodystrofi
Långvarig användning av insulin, inklusive Apidra, kan orsaka lipodystrofi på platsen för upprepade insulininjektioner eller infusion. Lipodystrofi inkluderar lipohypertrofi (förtjockning av fettvävnad) och lipoatrofi (gallring av fettvävnad) och kan påverka insulinabsorptionen. Rotera insulininjektion eller infusionsställen inom samma region för att minska risken för lipodystrofi. [Ser Dosering och administrering].
- Viktökning
Viktökning kan uppstå med insulinbehandling, inklusive Apidra, och har tillskrivits insulinets anabola effekter och minskningen av glukosuri.
- Perifert ödem
Insulin, inklusive Apidra, kan orsaka natriumretention och ödem, särskilt om tidigare dålig metabolisk kontroll förbättras genom intensifierad insulinbehandling.
- Biverkningar med kontinuerlig subkutan insulininfusion (CSII)
I en 12-veckors randomiserad studie på patienter med typ 1-diabetes (n = 59), var kateterhastigheterna ocklusioner och reaktioner på infusionsstället var liknande för patienter med Apidra och insulin aspart (Tabell 5).
Tabell 5: Kateterbeslut och reaktioner på infusionsställen.
| Apidra (N = 29) |
insulin aspart (N = 30) |
|
|---|---|---|
| Kateter okklusioner / månad | 0.08 | 0.15 |
| Reaktioner på infusionsstället | 10.3% (3/29) | 13.3% (4/30) |
- Allergiska reaktioner
Lokal allergi
Liksom med någon insulinbehandling kan patienter som tar Apidra uppleva rodnad, svullnad eller klåda på injektionsstället. Dessa mindre reaktioner löper vanligtvis på några dagar till några veckor, men i vissa tillfällen kan det behöva avbryta Apidra. I vissa fall kan dessa reaktioner vara relaterade till andra faktorer än insulin, såsom irriterande medel i ett hudrensande medel eller dålig injektionsteknik.
Systemisk allergi
Allvarlig, livshotande, generaliserad allergi, inklusive anafylax, kan förekomma med vilket insulin som helst, inklusive Apidra. Generaliserad allergi mot insulin kan orsaka utslag i hela kroppen (inklusive klåda), dyspné, väsande andning, hypotoni, takykardi eller diafores.
I kontrollerade kliniska studier upp till 12 månader rapporterades potentiella systemiska allergiska reaktioner hos 79 av 1833 patienter (4,3%) som fick Apidra och 58 av 1524 patienter (3,8%) som fick komparatorn kortverkande insuliner. Under dessa studier avbröts behandlingen med Apidra permanent hos 1 av 1833 patienter på grund av en potentiell systemisk allergisk reaktion.
Lokaliserade reaktioner och generaliserade myalgier har rapporterats med användning av metakresol, som är en hjälpämne för Apidra.
Antikroppsproduktion
I en studie på patienter med typ 1-diabetes (n = 333) har koncentrationerna av insulinantikroppar som reagerar med både humant insulin och insulin glulisin (korsreaktiva insulinantikroppar) förblev nära baslinjen under de första 6 månaderna av studien hos patienter behandlade med Apidra. En minskning av antikroppskoncentrationen observerades under de följande 6 månaderna av studien. I en studie på patienter med typ 2-diabetes (n = 411) var en liknande ökning av den korsreaktiva insulinantikroppskoncentrationen observerades hos patienter som behandlades med Apidra och hos patienter som behandlades med humant insulin under de första 9 månaderna av studie. Därefter minskade koncentrationen av antikroppar hos Apidra-patienterna och förblev stabil hos humana insulinpatienter. Det fanns ingen korrelation mellan korsreaktiv insulinantikroppskoncentration och förändringar i HbA1c, insulindoser eller förekomst av hypoglykemi. Den kliniska betydelsen av dessa antikroppar är inte känd.
Apidra framkallade inte ett signifikant antikroppssvar i en studie av barn och ungdomar med typ 1-diabetes.
Upplevelse efter marknadsföring
Följande biverkningar har identifierats under användning av Apidra efter godkännande.
Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller etablera ett orsakssamband till läkemedel exponering.
Läkemedelsfel har rapporterats där andra insuliner, särskilt långverkande insuliner, har administrerats av misstag istället för Apidra.
topp
Läkemedelsinteraktioner
Ett antal läkemedel påverkar glukosmetabolismen och kan kräva justering av insulindos och särskilt noggrann övervakning.
Läkemedel som kan öka den blodsockersänkande effekten av insuliner inklusive Apidra och därmed öka risken för hypoglykemi, inkluderar orala antidiabetika. pramlintid, ACE-hämmare, disopyramid, fibrater, fluoxetin, monoaminoxidasinhibitorer, propoxifen, pentoxifylline, salicylater, somatostatinanaloger och sulfonamid antibiotika.
Läkemedel som kan minska den blodsockersänkande effekten av Apidra inkluderar kortikosteroider, niacin, danazol, diuretika, sympatomimetiska medel (t.ex. epinefrin, albuterol, terbutalin), glukagon, isoniazid, fenotiazinderivat, somatropin, sköldkörtelhormoner, östrogener, progestogener (t.ex. i orala preventivmedel), proteashämmare och atypiska antipsykotika.
Betablockerare, klonidin, litiumsalter och alkohol kan antingen öka eller minska insulinens blodsockersänkande effekt.
Pentamidin kan orsaka hypoglykemi, som ibland kan följas av hyperglykemi.
Tecken på hypoglykemi kan reduceras eller saknas hos patienter som tar anti-adrenerga läkemedel såsom beta-blockerare, klonidin, guanetidin och reserpin.
topp
Användning i specifika befolkningar
Graviditet
Graviditetskategori C: Reproduktions- och teratologistudier har utförts med insulin glulisin hos råttor och kaniner med vanlig humant insulin som jämförelse. Insulin glulisin gavs till kvinnliga råttor under hela graviditeten i subkutana doser upp till 10 enheter / kg en gång dagligen (dos resulterande i en exponering 2 gånger den genomsnittliga humana dosen, baserat på jämförelse av kroppsytearea) och hade inte några anmärkningsvärda toxiska effekter på embryofoster utveckling.
Insulin glulisin gavs till kvinnliga kaniner under hela graviditeten i subkutana doser upp till 1,5 Enheter / kg / dag (dos som resulterar i en exponering 0,5 gånger den genomsnittliga humana dosen, baserat på kroppsytan jämförelse). Biverkningar på embryo-fosterutveckling sågs endast vid moderliga toxiska dosnivåer som inducerade hypoglykemi. Ökad förekomst av förluster efter implantation och skelettfel observerades vid en dosnivå på 1,5 enheter / kg en gång dagligen (dos vilket resulterade i en exponering 0,5 gånger den genomsnittliga humana dosen, baserat på jämförelse av kroppsytearea) som också orsakade dödligheten i dammar. En lätt ökad förekomst av förluster efter implantation sågs vid nästa lägre dosnivå på 0,5 enheter / kg en gång dagligen (dos resulterande i exponering 0,2 gånger den genomsnittliga humana dosen, baserad på jämförelse av kroppsytearea) som också var förknippad med svår hypoglykemi men det fanns inga fel dos. Inga effekter observerades hos kaniner i en dos av 0,25 enheter / kg en gång dagligen (dos som resulterade i en exponering 0,1 gånger den genomsnittliga humana dosen, baserat på jämförelse av kroppsytan). Effekterna av insulin glulisin skilde sig inte från de som observerades med subkutant regelbundet humant insulin i samma doser och tillskrivades sekundära effekter av moderlig hypoglykemi.
Det finns inga välkontrollerade kliniska studier av användning av Apidra på gravida kvinnor. Eftersom djurreproduktionsstudier inte alltid förutsäger mänsklig respons, bör detta läkemedel användas under graviditet endast om den potentiella nyttan motiverar den potentiella risken för fostret. Det är viktigt för patienter med diabetes eller en historia med graviditetsdiabetes att upprätthålla god metabolisk kontroll före befruktningen och under hela graviditeten. Insulinbehovet kan minska under första trimestern, öka i allmänhet under andra och tredje trimestern och minska snabbt efter förlossningen. Noggrann övervakning av glukoskontroll är nödvändig hos dessa patienter.
Ammande mödrar
Det är okänt om insulin glulisin utsöndras i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk bör försiktighet iakttas när Apidra ges till en ammande kvinna. Användning av Apidra är kompatibel med amning, men kvinnor med diabetes som ammar kan behöva justera insulindoserna.
Pediatrisk användning
Säkerheten och effektiviteten för subkutana injektioner av Apidra har fastställts hos barn (4 till 17 år) med diabetes typ 1 [Se Kliniska studier]. Apidra har inte studerats hos barn med diabetes typ 1 som är yngre än 4 år och hos barn med typ 2-diabetes.
Liksom hos vuxna måste Apidra-doseringen individualiseras hos barn, baserat på metaboliska behov och ofta övervakning av blodsocker.
Geriatrisk användning
I kliniska prövningar (n = 2408) administrerades Apidra till 147 patienter â € 65 år och 27 patienter â € 75 år. Majoriteten av denna lilla undergrupp av äldre patienter hade typ 2-diabetes. Förändringen i HbA1c-värden och hypoglykemi-frekvenser skilde sig inte efter ålder. Ändå bör försiktighet iakttas när Apidra ges till geriatriska patienter.
topp
överdosering
Överskott av insulin kan orsaka hypoglykemi och, särskilt när det ges intravenöst, hypokalemi. Milda avsnitt av hypoglykemi kan vanligtvis behandlas med oral glukos. Justeringar i läkemedelsdosering, måltidsmönster eller träning kan behövas. Mer allvarliga episoder av hypoglykemi med koma, krampanfall eller neurologisk nedsättning kan behandlas med intramuskulär / subkutan glukagon eller koncentrerad intravenös glukos. Fortsatt intag av kolhydrater och observation kan vara nödvändigt eftersom hypoglykemi kan återkomma efter uppenbar klinisk återhämtning. Hypokalemi måste korrigeras på lämpligt sätt.
Beskrivning
Apidra® (insulin glulisin [rDNA-ursprung] injektion) är en snabbverkande humaninsulinanalog som används för att sänka blodglukos. Insulin glulisin produceras genom rekombinant DNA-teknik med användning av en icke-patogen laboratoriestam av Escherichia coli (K12). Insulinn glulisin skiljer sig från humant insulin genom att aminosyran asparagin i position B3 ersätts av lysin och lysinet i position B29 ersätts av glutaminsyra. Kemiskt sett är insulin glulisin 3B-lysin-29B-glutaminsyra-humant insulin, har den empiriska formeln C258H384N64O78S6 och en molekylvikt 5823 och har följande strukturformel:
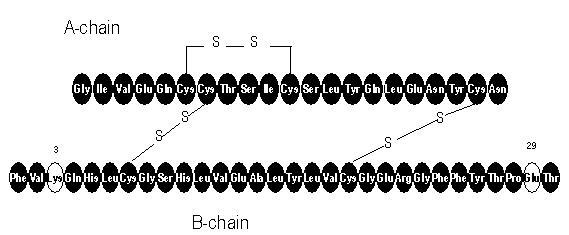
Apidra är en steril, vattenhaltig, klar och färglös lösning. Varje milliliter Apidra innehåller 100 enheter (3,49 mg) insulin glulisin, 3,15 mg metakresol, 6 mg trometamin, 5 mg natriumklorid, 0,01 mg polysorbat 20 och vatten för injektion. Apidra har ett pH på cirka 7,3. PH justeras genom tillsats av vattenhaltiga lösningar av saltsyra och / eller natriumhydroxid.
topp
Klinisk farmakologi
Handlingsmekanism
Reglering av glukosmetabolism är den primära aktiviteten hos insuliner och insulinanaloger, inklusive insulin glulisin. Insuliner sänker blodglukos genom att stimulera perifert glukosupptag av skelettmuskulatur och fett och genom att hämma glukosproduktion i lever. Insuliner hämmar lipolys och proteolys och förbättrar proteinsyntesen.
De glukosnedsänkande aktiviteterna hos Apidra och av vanligt humant insulin är ekvipotenta när de administreras via intravenös väg. Efter subkutan administration är effekten av Apidra snabbare i början och av kortare varaktighet jämfört med vanlig humant insulin. [Se farmakodynamik].
farmakodynamik
Studier på friska frivilliga och patienter med diabetes visade att Apidra har en snabbare början av verksamheten och en kortare aktivitetsperiod än vanlig humant insulin när det ges subkutant.
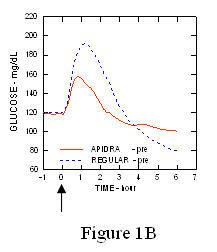
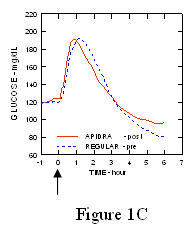
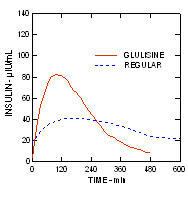
I en studie på patienter med typ 1-diabetes (n = 20), de glukosnedsänkande profilerna hos Apidra och regelbundet humant insulin utvärderades vid olika tidpunkter i förhållande till en standardmåltid i en dos av 0,15 Enheter / kg. (Figur 1.)
Den maximala blodglukosutflykten (Î ”GLUmax; baslinje subtraherat glukoskoncentration) för Apidra injicerat 2 minuter innan en måltid var 65 mg / dL jämfört med 64 mg / dL för vanlig människa insulin injicerat 30 minuter före en måltid (se figur 1A) och 84 mg / dL för vanlig humant insulin injicerat 2 minuter före en måltid (se figur 1B). Den maximala blodglukosutflykten för Apidra injicerad 15 minuter efter måltidens början var 85 mg / dL jämfört med 84 mg / dL för vanlig humant insulin injicerat 2 minuter före en måltid (se figur 1C).
Figur 1. Seriellt genomsnittligt blodglukos samlat upp till 6 timmar efter en enda dos Apidra och vanligt humant insulin. Apidra ges 2 minuter (Apidra - pre) innan en måltid började jämfört med vanlig humant insulin som ges 30 minuter (Regular - 30 min) före måltidens start (figur 1A) och jämfört med vanlig humant insulin (vanligt förekommande) ges 2 minuter före en måltid (figur 1B). Apidra ges 15 minuter (Apidra - post) efter start av en måltid jämfört med vanlig humant insulin (vanligt förekommande) ges 2 minuter före en måltid (figur 1C). På x-axeln noll (0) är början på en 15-minuters måltid.
 |
 |
 |
 |
I en randomiserad, öppen etikett, tvåvägs crossoverstudie, fick 16 friska manliga personer en intravenös infusion av Apidra eller vanlig humant insulin med saltlösningsutspädningsmedel med en hastighet av 0,8 milliUnits / kg / min för två timmarna. Infusion av samma dos Apidra eller vanligt humant insulin gav motsvarande glukosförvaring vid stabil tillstånd.
farmakokinetik
Absorption och biotillgänglighet
Farmakokinetiska profiler hos friska frivilliga och patienter med diabetes (typ 1 eller typ 2) visade att absorptionen av insulin glulisin var snabbare än hos vanlig humant insulin.
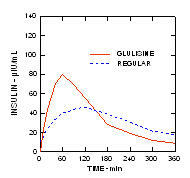
I en studie på patienter med typ 1-diabetes (n = 20) efter subkutan administrering av 0,15 enheter / kg, median tiden till maximal koncentration (Tmax) var 60 minuter (intervall 40 till 120 minuter) och toppkoncentrationen (Cmax) var 83 mikroenheter / ml (område 40 till 131 mikroenheter / ml) för insulin glulisin jämfört med en median Tmax på 120 minuter (intervall 60 till 239 minuter) och en Cmax på 50 mikroenheter / ml (intervall 35 till 71 mikroenheter / ml) för vanlig människa insulin. (Figur 2)
figur 2. Farmakokinetiska profiler av insulin glulisin och vanligt humant insulin hos patienter med typ 1-diabetes efter en dos på 0,15 enheter / kg.
Insulin glulisin och vanligt humant insulin administrerades subkutant i en dos av 0,2 enheter / kg i en euglykemisk klämstudie hos patienter med typ 2-diabetes (n = 24) och ett kroppsmassaindex (BMI) mellan 20 och 36 kg / m2. Mediantiden till maximal koncentration (Tmax) var 100 minuter (intervall 40 till 120 minuter) och median toppkoncentration (Cmax) var 84 mikroenheter / ml (område 53 till 165 mikroenheter / ml) för insulin glulisin jämfört med en median Tmax på 240 minuter (intervall 80 till 360 minuter) och en median Cmax på 41 mikroenheter / ml (intervall 33 till 61 mikroenheter / ml) för vanlig humant insulin. (Figur 3.)
Figur 3. Farmakokinetiska profiler av insulin glulisin och vanligt humant insulin hos patienter med diabetes typ 2 efter en subkutan dos på 0,2 enheter / kg.
När Apidra injicerades subkutant i olika delar av kroppen, var tidskoncentrationsprofilerna liknande. Den absoluta biotillgängligheten för insulin glulisin efter subkutan administrering är ungefär 70%, oavsett injektionsområde (buken 73%, deloid 71%, låret 68%).
I en klinisk studie på friska frivilliga (n = 32) var den totala tillgängligheten av insulin glulisin efter subkutan injektion av insulin glulisin och NPH-insulin (förblandad i sprutan) och efter separata samtidigt subkutan injektioner. Det var 27% dämpning av den maximala koncentrationen (Cmax) av Apidra efter förblandning; tiden till maximal koncentration (Tmax) påverkades emellertid inte. Det finns ingen information om blandning av Apidra med andra insulinpreparat än NPH-insulin. [Ser Kliniska studier].
Distribution och eliminering
Distribution och eliminering av insulin glulisin och vanligt humant insulin efter intravenös administration är likadana med distributionsvolymer på 13 och 21 L och halveringstider på 13 och 17 minuter, respektive. Efter subkutan administration elimineras insulin glulisin snabbare än vanligt humant insulin med en uppenbar halveringstid på 42 minuter jämfört med 86 minuter.
Klinisk farmakologi i specifika populationer
Pediatriska patienter
De farmakokinetiska och farmakodynamiska egenskaperna hos Apidra och vanligt humant insulin bedömdes i a studie genomförd på barn mellan 7 och 11 år (n = 10) och ungdomar 12 till 16 år (n = 10) med typ 1 diabetes. De relativa skillnaderna i farmakokinetik och farmakodynamik mellan Apidra och vanligt humant insulin i dessa patienter med typ 1-diabetes liknade de hos friska vuxna individer och vuxna med typ 1 diabetes.
Lopp
En studie bland 24 friska kaukasier och japanska patienter jämförde farmakokinetiken och farmakodynamiken efter subkutan injektion av insulin glulisin, insulin lispro och vanligt humant insulin. Med subkutan injektion av insulin glulisin hade japanska personer större initial exponering (33%) för förhållandet AUC (0-1h) till AUC (0-klämma ände) än kaukasier (21%) även om de totala exponeringarna var liknande. Det fanns liknande resultat med insulin lispro och vanlig humant insulin.
Fetma
Insulin glulisin och vanligt humant insulin administrerades subkutant i en dos av 0,3 enheter / kg i en euglykemisk klämstudie hos feta, icke-diabetiska personer (n = 18) med ett kroppsmassaindex (BMI) mellan 30 och 40 kg / m2. Mediantiden till maximal koncentration (Tmax) var 85 minuter (intervall 49 till 150 minuter) och median toppkoncentration (Cmax) var 192 mikrounit / ml (intervall 98 till 380 mikroenheter / ml) för insulin glulisin jämfört med en median Tmax på 150 minuter (intervall 90 till 240 minuter) och en median Cmax på 86 mikroenheter / ml (intervall 43 till 175 mikroenheter / ml) för vanlig människa insulin.
Den snabbare insättningen och kortare aktivitetsperiod för Apidra och insulin lispro jämfört med vanlig humant insulin bibehölls i en fetma icke-diabetisk population (n = 18). (Figur 4.)
Figur 4. Glukosinfusionshastigheter (GIR) i en euglycemisk klämstudie efter subkutan injektion av 0,3 enheter / kg Apidra, insulin lispro eller vanlig humant insulin i en överviktig population.

Nedsatt njurfunktion
Studier med humant insulin har visat ökade cirkulationsnivåer av insulin hos patienter med njursvikt. I en studie som utförts på 24 icke-diabetiska personer med normal njurfunktion (ClCr> 80 ml / min), måttligt nedsatt njurfunktion (30-50 ml / min) och allvarlig nedsatt njurfunktion (Varningar och försiktighetsåtgärder).
Nedsatt leverfunktion
Effekten av nedsatt leverfunktion på Apidras farmakokinetik och farmakodynamik har inte studerats. Vissa studier med humant insulin har visat ökade cirkulationsnivåer av insulin hos patienter med leversvikt. [Ser Varningar och försiktighetsåtgärder].
Kön
Effekten av kön på farmakokinetiken och farmakodynamiken hos Apidra har inte studerats.
Graviditet
Effekten av graviditet på farmakokinetiken och farmakodynamiken hos Apidra har inte studerats.
Rökning
Effekten av rökning på farmakokinetiken och farmakodynamiken hos Apidra har inte studerats.
topp
Icke-klinisk toxikologi
Karcinogenes, mutagenes, nedsatt fertilitet
Standard 2-åriga karcinogenicitetsstudier på djur har inte utförts. Hos Sprague Dawley-råttor genomfördes en tolvmånaders toxicitetstudie vid upprepad dos med insulin glulisin i subkutana doser av 2,5, 5, 20 eller 50 enheter / kg två gånger dagligen (dos som resulterar i exponering 1, 2, 8 och 20 gånger den genomsnittliga humana dosen, baserat på kroppens ytarea jämförelse).
Det fanns en icke-dosberoende högre förekomst av tumörer i bröstkörtlar hos kvinnliga råttor som gav insulin glulisin jämfört med obehandlade kontroller. Förekomsten av brösttumörer för insulin glulisin och vanligt humant insulin var liknande. Relevansen av dessa fynd för människor är inte känd. Insulinnglulisin var inte mutagent i följande test: Ames-test, in vitro däggdjurskromosom aberrationstest i V79 kinesiska hamsterceller och in vivo däggdjurens erytrocytmikronukleustest i råttor.
I fertilitetsstudier på råttor av hankön och kvinnor vid subkutana doser upp till 10 enheter / kg en gång dagligen (dos som resulterar i en exponering 2 gånger den genomsnittliga människan dos, baserat på jämförelse av kroppsytearea), var inga tydliga negativa effekter på fertilitet hos män och kvinnor eller djurens allmänna reproduktionsprestanda observeras.
topp
Kliniska studier
Säkerheten och effekten av Apidra studerades på vuxna patienter med typ 1 och typ 2-diabetes (n = 1833) och hos barn och ungdomspatienter (4 till 17 år) med typ 1-diabetes (n = 572). Den primära effektivitetsparametern i dessa studier var glykemisk kontroll, bedömd med användning av glykerat hemoglobin (GHb rapporterat som HbA1c-ekvivalent).
Diabetes-vuxna av typ 1
En 26-veckors, randomiserad, öppen etikett, aktivt kontrollerad, icke-underlägsenhetsstudie utfördes på patienter med typ 1-diabetes för att utvärdera säkerhet och effekt av Apidra (n = 339) jämfört med insulin lispro (n = 333) vid administrering subkutant inom 15 minuter före en måltid. Insulin glargin administrerades en gång dagligen på kvällen som basalinsulin. Det fanns en 4-veckors körningstid med insulin lispro och insulin glargine före randomisering. De flesta patienter var kaukasiska (97%). Femton åtta procent av patienterna var män. Medelåldern var 39 år (intervall 18 till 74 år). Glykemisk kontroll, antalet dagliga kortverkande insulininjektioner och de totala dagliga doserna av Apidra och insulin lispro var liknande i de två behandlingsgrupperna (tabell 6).
Tabell 6: Typ 1 Diabetes Mellitus - vuxen
| Behandlingstid Behandling i kombination med: |
26 veckor Insulin glargin |
|
|---|---|---|
| Apidra | Insulin Lispro | |
| ||
| Glykerat hemoglobin (GHb)* (%) | ||
| Antal patienter | 331 | 322 |
| Basvärde | 7.6 | 7.6 |
| Justerad genomsnittlig förändring från baslinjen | -0.1 | -0.1 |
| Behandlingsskillnad: Apidra - Insulin Lispro | 0.0 | |
| 95% CI för behandlingsskillnad | (-0.1; 0.1) | |
| Basal insulindos (Enheter / dag) | ||
| Basvärde | 24 | 24 |
| Justerad genomsnittlig förändring från baslinjen | 0 | 2 |
| Kortverkande insulindos (Enheter / dag) | ||
| Basvärde | 30 | 31 |
| Justerad genomsnittlig förändring från baslinjen | -1 | -1 |
| Medelantal kortverkande insulininjektioner per dag | 3 | 3 |
| Kroppsvikt (kg) | ||
| Basvärde | 73.9 | 74.1 |
| Genomsnittlig förändring från baslinjen | 0.6 | 0.3 |
Diabetes-vuxna av typ 2
En 26-veckors, slumpmässig, öppen etikett, aktivt kontrollerad, icke-underlägsenhetsstudie genomfördes på insulinbehandlade patienter med typ 2-diabetes för att bedöma säkerhet och effekt av Apidra (n = 435) ges inom 15 minuter före en måltid jämfört med vanlig humant insulin (n = 441) administrerat 30 till 45 minuter före en måltid. NPH-humant insulin gavs två gånger om dagen som basalt insulin. Samtliga patienter deltog i en 4-veckors förberedelseperiod med vanlig humant insulin och NPH humant insulin. 85 procent av patienterna var kaukasiska och 11% var svarta. Medelåldern var 58 år (intervall 26 till 84 år). Det genomsnittliga kroppsmassaindexet (BMI) var 34,6 kg / m2. Vid randomisering tog 58% av patienterna ett oralt antidiabetiskt medel. Dessa patienter instruerades att fortsätta använda sitt orala antidiabetiska medel i samma dos under hela försöket. Majoriteten av patienterna (79%) blandade sitt kortverkande insulin med NPH humant insulin omedelbart före injektionen. Reduktionerna från baslinjen i GHb var liknande mellan de två behandlingsgrupperna (se tabell 7). Inga skillnader mellan Apidra och vanliga humana insulingrupper sågs i antalet dagliga kortverkande insulininjektioner eller basala eller kortverkande insulindoser. (Se tabell 7.)
Tabell 7: Typ 2-diabetes mellitus-adult
| Behandlingstid | 26 veckor | |
|---|---|---|
| Behandling i kombination med: | NPH humant insulin | |
| Apidra | Vanligt humant insulin | |
| ||
| Glykerat hemoglobin (GHb)* (%) | ||
| Antal patienter | 404 | 403 |
| Basvärde | 7.6 | 7.5 |
| Justerad genomsnittlig förändring från baslinjen | -0.5 | -0.3 |
| Behandlingsskillnad: Apidra - Vanligt humant insulin | -0.2 | |
| 95% CI för behandlingsskillnad | (-0.3; -0.1) | |
| Basal insulindos (Enheter / dag) | ||
| Basvärde | 59 | 57 |
| Justerad genomsnittlig förändring från baslinjen | 6 | 6 |
| Kortverkande insulindos (Enheter / dag) | ||
| Basvärde | 32 | 31 |
| Justerad genomsnittlig förändring från baslinjen | 4 | 5 |
| Medelantal kortverkande insulininjektioner per dag | 2 | 2 |
| Kroppsvikt (kg) | ||
| Basvärde | 100.5 | 99.2 |
| Genomsnittlig förändring från baslinjen | 1.8 | 2.0 |
Diabetes-vuxna av typ 1: Administrering före och efter måltid
En 12-veckors, randomiserad, öppen etikett, aktivt kontrollerad, icke-underlägsenhetsstudie genomfördes på patienter med typ 1-diabetes för att bedöma säkerheten och effekten av Apidra som administreras vid olika tidpunkter med avseende på a måltid. Apidra administrerades subkutant antingen inom 15 minuter före en måltid (n = 286) eller omedelbart efter en måltid (n = 296) och vanligt humant insulin (n = 278) administrerades subkutant 30 till 45 minuter före en måltid. Insulin glargin administrerades en gång dagligen vid sänggåendet som basalinsulin. Det fanns en 4-veckors uppkörningsperiod med regelbundet humant insulin och insulin glargin följt av randomisering. De flesta patienter var kaukasiska (94%). Medelåldern var 40 år (intervall 18 till 73 år). Glykemisk kontroll (se tabell 8) var jämförbar för de 3 behandlingsregimerna. Inga förändringar från baslinjen mellan behandlingarna sågs i det totala dagliga antalet kortverkande insulininjektioner. (Se tabell 8.)
Tabell 8: Administration före och efter måltid vid typ 1-diabetes mellitus-adult
| Behandlingstid Behandling i kombination med: |
12 veckor insulin glargine |
12 veckor insulin glargine |
12 veckor insulin glargine |
|---|---|---|---|
| Apidra före måltid |
Apidra efter måltid |
Vanligt humant insulin | |
| |||
| Glykerat hemoglobin (GHb)* (%) | |||
| Antal patienter | 268 | 276 | 257 |
| Basvärde | 7.7 | 7.7 | 7.6 |
| Justerad genomsnittlig förändring från baslinjen†| -0.3 | -0.1 | -0.1 |
| Basal insulindos (Enheter / dag) | |||
| Basvärde | 29 | 29 | 28 |
| Justerad genomsnittlig förändring från baslinjen | 1 | 0 | 1 |
| Kortverkande insulindos (Enheter / dag) | |||
| Basvärde | 29 | 29 | 27 |
| Justerad genomsnittlig förändring från baslinjen | -1 | -1 | 2 |
| Medelantal kortverkande insulininjektioner per dag | 3 | 3 | 3 |
| Kroppsvikt (kg) | |||
| Basvärde | 79.2 | 80.3 | 78.9 |
| Genomsnittlig förändring från baslinjen | 0.3 | -0.3 | 0.3 |
Diabetes-pediatriska patienter av typ 1
En 26-veckors, randomiserad, öppen etikett, aktivt kontrollerad, icke-underlägsenhetsstudie genomfördes på barn och ungdomar äldre än 4 år med typ 1 diabetes mellitus för att bedöma säkerheten och effekten av Apidra (n = 277) jämfört med insulin lispro (n = 295) vid administrering subkutant inom 15 minuter före en måltid. Patienter fick också insulin glargin (administrerat en gång dagligen på kvällen) eller NPH-insulin (administrerat en gång på morgonen och en gång på kvällen). Det fanns en 4-veckors körning med insulin lispro och insulin glargine eller NPH före randomisering. De flesta patienter var kaukasiska (91%). Femtio procent av patienterna var manliga. Medelåldern var 12,5 år (intervall 4 till 17 år). Genomsnittligt BMI var 20,6 kg / m2. Glykemisk kontroll (se tabell 9) var jämförbar för de två behandlingsregimerna.
Tabell 9: Resultat från en 26-veckors studie på pediatriska patienter med typ 1-diabetes mellitus
| Apidra | lispro | |
|---|---|---|
| Antal patienter | 271 | 291 |
| Basal insulin | NPH eller insulin glargin | NPH eller insulin glargin |
| ||
| Glykerat hemoglobin (GHb)* (%) | ||
| Basvärde | 8.2 | 8.2 |
| Justerad genomsnittlig förändring från baslinjen | 0.1 | 0.2 |
| Behandlingsskillnad: Medel (95% konfidensintervall) | -0.1 (-0.2, 0.1) | |
| Basal insulindos (Enheter / kg / dag) | ||
| Basvärde | 0.5 | 0.5 |
| Genomsnittlig förändring från baslinjen | 0.0 | 0.0 |
| Kortverkande insulindos (Enheter / kg / dag) | ||
| Basvärde | 0.5 | 0.5 |
| Genomsnittlig förändring från baslinjen | 0.0 | 0.0 |
| Medelantal kortverkande insulininjektioner per dag | 3 | 3 |
| Baslinje medelvikt (kg) | 51.5 | 50.8 |
| Medelviktförändring från baslinjen (kg) | 2.2 | 2.2 |
Diabetes-vuxna av typ 1: Kontinuerlig subkutan insulininfusion
En 12-veckors randomiserad, aktiv kontrollstudie (Apidra kontra insulin aspart) genomförd hos vuxna med typ 1-diabetes (Apidra n = 29, insulin aspart n = 30) utvärderade användningen av Apidra i ett externt kontinuerligt subkutant insulin pump. Alla patienter var kaukasiska. Medelåldern var 46 år (intervall 21 till 73 år). Genomsnittligt GHb ökade från baslinjen till slutpunkten i båda behandlingsgrupperna (från 6,8% till 7,0% för Apidra; från 7,1% till 7,2% för insulin aspart).
topp
Hur levereras / lagring och hantering
Hur levereras
| |
| Apidra 100 enheter per ml (U-100) är tillgängligt som: | |
| 10 ml injektionsflaskor | NDC 0088-2500-33 |
| 3 ml patronsystem*, paket med 5 | NDC 0088-2500-52 |
| 3 ml SoloStar förfylld penna, paket med 5 | NDC 0088-2502-05 |
Pennor inkluderas inte i förpackningarna.
BD Ultra-Fine ™ penna nålar 1 som ska användas i samband med OptiClik säljs separat och tillverkas av Becton Dickinson och Company.
Solostar är kompatibel med alla pennnålar från Becton Dickinson and Company, Ypsomed och Owen Mumford.
Lagring
Använd inte det efter utgångsdatumet (se kartong och behållare).
Oöppnat injektionsflaska / patronsystem / SoloStar
Oöppnade Apidra-injektionsflaskor, patronsystem och SoloStar ska förvaras i kylskåp, 2 ° C-8 ° C. Skydda mot ljus. Apidra ska inte förvaras i frysen och det får inte frysas. Kassera om den har frysts.
Oöppnade injektionsflaskor / patronsystem / SoloStar som inte förvaras i kylskåp måste användas inom 28 dagar.
Öppen (i användning) injektionsflaska:
Öppnade injektionsflaskor, oavsett om de är kylda, måste användas inom 28 dagar. Om kylning inte är möjlig, kan det öppna injektionsflaskan som används hållas okylt i upp till 28 dagar från direkt värme och ljus, så länge temperaturen inte är högre än 25 ° C.
Öppet (i användning) kassettsystem:
Det öppnade (i användning) kassettsystemet som sätts in i OptiClik® ska INTE kylas utan ska hållas under 25 ° C borta från direkt värme och ljus. Det öppnade (i användning) patronsystemet måste kasseras efter 28 dagar. Förvara inte OptiClik®, med eller utan kassettesystem, i kylskåp när som helst.
Öppen (i användning) SoloStar förfylld penna:
Den öppnade (under användning) SoloStar ska INTE kylas utan ska hållas under 25 ° C borta från direkt värme och ljus. Den öppna (under användning) SoloStar som hålls vid rumstemperatur måste kasseras efter 28 dagar.
Infusionsuppsättningar:
Infusionsuppsättningar (behållare, slangar och katetrar) och Apidra i behållaren ska kasseras efter 48 timmars användning eller efter exponering för temperaturer som överstiger 37 ° C (37,6 ° F).
Intravenös användning:
Infusionspåsar framställda enligt anvisningarna under DOSERING OCH ADMINISTRERING är stabila vid rumstemperatur i 48 timmar.
Förberedelse och hantering
Efter utspädning för intravenös användning bör lösningen inspekteras visuellt med avseende på partiklar och missfärgning före administrering. Använd inte lösningen om den har blivit grumlig eller innehåller partiklar. använd endast om det är klart och färglöst. Apidra är inte kompatibel med Dextrose-lösning och Ringers-lösning och kan därför inte användas med dessa lösningsvätskor. Användningen av Apidra med andra lösningar har inte studerats och rekommenderas därför inte.
Patronsystem: Om OptiClik® (Insulin Delivery Device for Apidra) fungerar, kan Apidra dras från patronsystemet till en U-100-spruta och injiceras.
Apidra, insulin glusine, patientinformation (på vanligt engelska)
senast uppdaterad: 02/2009
Detaljerad information om tecken, symtom, orsaker, behandling av diabetes
Informationen i denna monografi är inte avsedd att täcka alla möjliga användningar, anvisningar, försiktighetsåtgärder, läkemedelsinteraktioner eller negativa effekter. Denna information är generaliserad och är inte avsedd som specifik medicinsk rådgivning. Om du har frågor om läkemedlen du tar eller vill ha mer information, kontakta din läkare, apotekspersonal eller sjuksköterska.
tillbaka till: Bläddra bland alla mediciner för diabetes



