Glukofag för behandling av diabetes
Varumärke: Glucophage
Generiskt namn: metforminhydroklorid
Doseringsform: tabletter med förlängd frisättning
Innehåll:
Beskrivning
Klinisk farmakologi
Indikationer och användning
Kontra
varningar
försiktighetsåtgärder
Läkemedelsinteraktioner
Negativa reaktioner
Överdos
Dosering
levereras
Glukohage, metforminhydroklorid, patientinformation (på vanligt engelska)
Beskrivning
Glucophage® (metforminhydroklorid) tabletter och Glucophage® XR (metformin hydroklorid) tabletter med förlängd frisättning är orala antihyperglykemiska läkemedel som används vid hantering av typ 2-diabetes. Metforminhydroklorid (N, N-dimetylimidodikarbonimidisk diamidhydroklorid) är inte kemiskt eller farmakologiskt relaterat till några andra klasser av orala antihyperglykemiska medel. Strukturformeln är som visas:
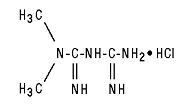
Metforminhydroklorid är en vit till benvit kristallin förening med en molekylformel av C4H11N5 - HCl och en molekylvikt av 165,63. Metforminhydroklorid är fritt lösligt i vatten och är praktiskt taget olösligt i aceton, eter och kloroform. PKa för metformin är 12,4. PH för en 1% -ig vattenlösning av metforminhydroklorid är 6,68.
Glukofag-tabletter innehåller 500 mg, 850 mg eller 1000 mg metforminhydroklorid. Varje tablett innehåller de inaktiva ingredienserna povidon och magnesiumstearat. Dessutom innehåller beläggningen för 500 mg och 850 mg tabletter hypromellos och beläggningen för 1000 mg tablett innehåller hypromellos och polyetylenglykol.
Glucophage XR innehåller 500 mg eller 750 mg metforminhydroklorid som den aktiva ingrediensen.
Glucophage XR 500 mg tabletter innehåller de inaktiva ingredienserna natriumkarboximetylcellulosa, hypromellos, mikrokristallin cellulosa och magnesiumstearat.
Glucophage XR 750 mg tabletter innehåller de inaktiva ingredienserna natriumkarboximetylcellulosa, hypromellos och magnesiumstearat.
Systemkomponenter och Performance-Glucophage XR innefattar ett dubbelt hydrofilt polymermatrissystem. Metforminhydroklorid kombineras med en läkemedelsfrisättningskontrollerande polymer för att bilda en "inre" fas, vilken sedan införlivas som separata partiklar i en "extern" fas av en andra polymer. Efter administrering kommer vätska från mag-tarmkanalen in i tabletten, vilket får polymererna att hydrera och svälla. Läkemedel frisätts långsamt från doseringsformen genom ett diffusionsförfarande genom gelmatrisen som är väsentligen oberoende av pH. Det hydratiserade polymersystemet är inte styvt och förväntas brytas upp genom normal peristaltis i GI-kanalen. De biologiskt inerta komponenterna i tabletten kan ibland förbli intakta under GI-transitering och kommer att elimineras i avföringen som en mjuk, hydratiserad massa.
topp
Klinisk farmakologi
Handlingsmekanism
Metformin är ett antihyperglykemiskt medel som förbättrar glukostoleransen hos patienter med typ 2-diabetes och sänker både basal och postprandial plasmaglukos. Dess farmakologiska verkningsmekanismer skiljer sig från andra klasser av orala antihyperglykemiska medel. Metformin minskar glukosproduktionen i levern, minskar tarmabsorptionen av glukos och förbättrar insulinkänsligheten genom att öka perifert glukosupptag och användning. Till skillnad från sulfonylurea producerar metformin inte hypoglykemi hos varken patienter med typ 2-diabetes eller normala personer (förutom under speciella omständigheter, se FÖRSIKTIGHETSÅTGÄRDER) och orsakar inte hyperinsulinemi. Med metforminbehandling förblir insulinsekretion oförändrat medan fastande insulinnivåer och dagslång insulinsvar i plasma faktiskt kan minska.
farmakokinetik
Absorption och biotillgänglighet
Den absoluta biotillgängligheten för en Glucophage 500 mg tablett som ges under fastaförhållanden är cirka 50% till 60%. Studier som använder enstaka orala doser av Glucophage 500 till 1500 mg och 850 till 2550 mg, indikerar att det saknas dosproportionalitet med ökande doser, vilket beror på minskad absorption snarare än en förändring i eliminering. Livsmedel minskar omfattningen av och försenar absorptionen av metformin något, vilket visas av ungefär 40% lägre genomsnittlig toppplasma koncentration (Cmax), en 25% lägre yta under plasmakoncentrationen kontra tidskurva (AUC) och en 35-minuters förlängning av tid till topp plasmakoncentration (Tmax) efter administrering av en enda 850 mg tablett metformin med mat, jämfört med samma tablettstyrka administrerad fasta. Den kliniska relevansen av dessa minskningar är okänd.
Efter en enda oral dos av Glucophage XR uppnås Cmax med ett medianvärde av 7 timmar och ett intervall från 4 till 8 timmar. Maximala plasmanivåer är ungefär 20% lägre jämfört med samma dos av Glucophage, men absorptionsgraden (mätt med AUC) liknar Glucophage.
Vid stabil tillstånd är AUC och Cmax mindre än dosproportionella för Glucophage XR inom intervallet 500 till 2000 mg som administreras en gång dagligen. Maximala plasmanivåer är ungefär 0,6, 1,1, 1,4 och 1,8 ug / ml för 500, 1000, 1500 och 2000 mg doser en gång dagligen. Graden av metforminabsorption (mätt med AUC) från Glucophage XR vid en dos på 2000 mg en gång dagligen liknar samma totala dagliga dos som administreras som Glucophage tabletter 1000 mg två gånger dagligen. Efter upprepad administrering av Glucophage XR ackumulerades metformin inte i plasma.
Variation inom ämnet inom Cmax och AUC för metformin från Glucophage XR är jämförbar med den med Glucophage.
Även om omfattningen av metforminabsorption (mätt med AUC) från Glucophage XR-tablett ökade med cirka 50% när det ges med mat, det fanns ingen effekt av mat på Cmax och Tmax av metformin. Både måltider med hög fetthalt och låg fetthalt hade samma effekt på farmakokinetiken för Glucophage XR.
Distribution
Den uppenbara distributionsvolymen (V / F) av metformin efter enstaka orala doser av Glucophage 850 mg var i genomsnitt 654 ± 358 L. Metformin är försumbart bundet till plasmaproteiner, till skillnad från sulfonylurea, som är mer än 90% proteinbundet. Metforminpartitioner i erytrocyter, troligtvis som en funktion av tiden. Vid vanliga kliniska doser och doseringsscheman för glukofag uppnås plasmakoncentrationer av metformin i steady state inom 24 till 48 timmar och är i allmänhet
Metabolism och eliminering
Intravenösa enkeldosstudier på normala försökspersoner visar att metformin utsöndras oförändrat i urin och genomgår inte levermetabolism (inga metaboliter har identifierats hos människor) inte heller gallvägar exkretion. Renal clearance (se bord 1) är ungefär 3,5 gånger större än kreatininclearance, vilket indikerar att tubulär sekretion är den viktigaste vägen för eliminering av metformin. Efter oral administrering elimineras cirka 90% av det absorberade läkemedlet via njurvägen inom de första 24 timmarna, med en plasmahalveringstid på cirka 6,2 timmar. I blod är halveringstiden för eliminering ungefär 17,6 timmar, vilket antyder att erytrocytmassan kan vara ett fördelningsfack.
Särskilda befolkningar
Patienter med typ 2-diabetes
I närvaro av normal njurfunktion finns det inga skillnader mellan en- eller multipeldos farmakokinetik av metformin mellan patienter med typ 2-diabetes och normala individer (se bord 1Det finns inte heller någon ansamling av metformin i någon grupp vid vanliga kliniska doser.
Farmakokinetiken för Glucophage XR hos patienter med typ 2-diabetes är jämförbar med dem hos friska normala vuxna.
Nedsatt njurfunktion
Hos patienter med nedsatt njurfunktion (baserat på uppmätt kreatininclearance) har plasma och blodhalveringstid metformin är långvarigt och renal clearance minskas i proportion till minskningen av kreatininclearance (se bord 1; se också VARNINGAR).
Nedsatt leverfunktion
Inga farmakokinetiska studier av metformin har utförts på patienter med leverinsufficiens.
Geriatri
Begränsade data från kontrollerade farmakokinetiska studier av glukofag hos friska äldre individer tyder på att total plasma clearance av metformin minskas, halveringstiden förlängs och Cmax ökar jämfört med friska unga ämnen. Av dessa data verkar det som om förändringen i metformins farmakokinetik med åldrande främst beror på en förändring av njurfunktionen (se bord 1). Glucophage (metformin hydrochloride) tabletter och Glucophage XR (metformin hydrochloride) Behandling med utökade frisättande tabletter bör inte initieras hos patienter på 80 år, om inte mätning av kreatininclearance visar att njurfunktionen inte reduceras (ser VARNINGAR och DOSERING OCH ADMINISTRERING).
Tabell 1: Välj medelvärde (± S.D.) Metformin farmakokinetiska parametrar efter enstaka eller flera orala doser av glukofag
| Ämnesgrupper: glukofagdosen (antal ämnen) |
Cmaxb (pg / ml) |
Tmaxc (timmar) |
Renal clearance (Ml / min) |
|---|---|---|---|
| en Alla doser som fick fastande utom de första 18 doserna av flerdosstudierna | |||
| b Maximal plasmakoncentration | |||
| c Dags att toppa plasmakoncentrationen | |||
| d Kombinerade resultat (medelvärde) för fem studier: medelålder 32 år (intervall 23-59 år) | |||
| e Kinetisk studie utförd efter dos 19, fastat | |||
| f Äldre personer, medelålder 71 år (intervall 65-81 år) | |||
| g CLcr = kreatininclearance normaliserat till kroppens ytarea på 1,73 m2 | |||
| Friska, icke-diabetiska vuxna: | |||
| 500 mg enstaka dos (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg enstaka dos (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg tre gånger dagligen under 19 dosere (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Vuxna med typ 2-diabetes: | |||
| 850 mg enstaka dos (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg tre gånger dagligen under 19 dosere (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| Äldref, friska icke-diabetiska vuxna: | |||
| 850 mg enstaka dos (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Nedsatt nedsatt vuxna: | |||
| 850 mg enstaka dos | |||
| Mild (CLcrg 61-90 ml / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Måttlig (CLcr 31-60 ml / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Svår (CLcr 10-30 ml / min) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
Pediatrik
Efter administrering av en enda oral Glucophage 500 mg tablett med mat, skilde sig geometriskt medelvärde metformin Cmax och AUC mindre än 5% mellan pediatriska diabetespatienter av typ 2 (12-16 år) och friska vuxna med kön och vikt matchade (20-45 år), alla med normal njure fungera
Kön
Metformins farmakokinetiska parametrar skilde sig inte signifikant mellan normala patienter och patienter med typ 2-diabetes när de analyserades enligt kön (män = 19, kvinnor = 16). I kontrollerade kliniska studier på patienter med typ 2-diabetes var på samma sätt den antihyperglykemiska effekten av glukofag jämförbar hos män och kvinnor.
Lopp
Inga studier av farmakokinetiska metforminparametrar enligt ras har utförts. I kontrollerade kliniska studier av glukofag hos patienter med typ 2-diabetes var den antihyperglykemiska effekten jämförbar hos vita (n = 249), svarta (n = 51) och Hispanics (n = 24).
Kliniska studier
Glucophage
I en dubbelblind, placebokontrollerad, multicenter, amerikansk klinisk studie som involverade feta patienter med typ 2-diabetes vars hyperglykemi inte kontrollerades tillräckligt med kostbehandling ensam (baslinjefasta plasmaglukos [FPG] på cirka 240 mg / dL), behandling med glukofag (upp till 2550 mg / dag) under 29 veckor resulterade i betydande medelreduktion i fastande och postprandial plasmaglukos (PPG) och hemoglobin A1c (HbA1c) på 59 mg / dL, 83 mg / dL respektive 1,8%, jämfört med placebogruppen (se Tabell 2).
Tabell 2: Glukofag kontra placebo-sammanfattning av genomsnittliga förändringar från baslinjen * i fastande plasmaglukos, HbA1coch kroppsvikt, vid sista besök (29-veckors studie)
| Glucophage (N = 141) |
Placebo (N = 145) |
p-värde | |
|---|---|---|---|
| * Alla patienter på dietterapi vid baslinjen | ** Inte statistiskt signifikant | ||
| FPG (mg / dL) Baseline Ändra vid SLUTBESÖK |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Hemoglobin A1c (%) Baseline Ändra vid SLUTBESÖK |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Kroppsvikt (kg) Baseline Ändra vid SLUTBESÖK |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
En 29-veckors, dubbelblind, placebokontrollerad studie av Glucophage och glyburid, enbart och i kombination, genomfördes hos överviktiga patienter med typ 2 diabetes som inte lyckats uppnå tillräcklig glykemisk kontroll under maximala doser av glyburid (baslinje FPG på cirka 250 mg / dL) (se tabell 3). Patienter randomiserade till kombinationsarmen startade behandling med Glucophage 500 mg och glyburid 20 mg. I slutet av varje vecka under de första fyra veckorna av försöket fick dessa patienter sina doser av glukofag ökade med 500 mg om de inte hade lyckats nå målfasta plasmaglukos. Efter vecka 4 gjordes sådana dosjusteringar varje månad, även om ingen patient fick överskrida Glucophage 2500 mg. Patienter i Glucophage-armen (metformin plus placebo) följde samma titreringsschema. I slutet av studien tog cirka 70% av patienterna i kombinationsgruppen Glucophage 2000 mg / glyburide 20 mg eller Glucophage 2500 mg / glyburide 20 mg. Patienter som randomiserades för att fortsätta på glyburid upplevde en försämring av glykemisk kontroll med medelökningar i FPG, PPG och HbA1c på 14 mg / dL, 3 mg / dL respektive 0,2%. Däremot upplevde de som randomiserats till Glucophage (upp till 2500 mg / dag) en liten förbättring, med medelreduktioner i FPG, PPG och HbA1c på 1 mg / dL, 6 mg / dL respektive 0,4%. Kombinationen av glukofag och glyburid var effektiv för att reducera FPG-, PPG- och HbA1c-nivåer med 63 mg / dL, 65 mg / dL respektive 1,7%. Jämfört med resultaten av glyburidbehandling enbart var nettodifferenserna med kombinationsbehandling -77 mg / dL, -68 mg / dL respektive -1,9% (se tabell 3).
Tabell 3: Kombinerad glukofag / glyburid (kam) vs glyburid (glyb) eller glukofag (GLU) monoterapi: Sammanfattning av genomsnittliga förändringar från baslinjen * i fastande plasmaglukos, HbA1coch kroppsvikt, vid sista besök (29-veckors studie)
| p-värden | ||||||
|---|---|---|---|---|---|---|
| Hårkam (N = 213) |
Glyb (N = 209) |
GLU (N = 210) |
Glyb vs Hårkam |
GLU vs Hårkam |
GLU vs Glyb |
|
| * Alla patienter på glyburid, 20 mg / dag, vid baslinjen | ** Inte statistiskt signifikant | |||||
| Fastande plasmaglukos (mg / dL) | ||||||
| Baseline Ändra vid SLUTBESÖK |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Hemoglobin A1c (%) | ||||||
| Baseline Ändra vid SLUTBESÖK |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Kroppsvikt (kg) | ||||||
| Baseline Ändra vid SLUTBESÖK |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Storleken på nedgången i fastande blodglukoskoncentration efter institutionen Glukofag (metforminhydroklorid) tabletter terapi var proportionell mot fasta nivån hyperglykemi. Patienter med typ 2-diabetes med högre fastande glukoskoncentrationer upplevde större minskningar av plasmaglukos och glykosylerat hemoglobin.
I kliniska studier sänkte Glucophage, ensam eller i kombination med en sulfonylurea, genomsnittligt fasta serum triglycerider, totalt kolesterol och LDL-kolesterolnivåer och hade inga negativa effekter på andra lipidnivåer (se Tabell 4).
Tabell 4: Sammanfattning av genomsnittlig procentuell förändring från baslinjen för stora serumlipidvariabler vid slutbesök (29-veckors studier)
| Glukofag vs Placebo | Kombinerad glukofag / glyburid vs monoterapi |
||||
|---|---|---|---|---|---|
| Glucophage (N = 141) |
Placebo (N = 145) |
Glucophage (N = 210) |
Glucophage / Glyburide (N = 213) |
Glyburide (N = 209) |
|
| Totalt kolesterol (mg / dL) | |||||
| Baseline Genomsnittlig% förändring vid SLUTBESÖK |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Totala triglycerider (mg / dL) | |||||
| Baseline Genomsnittlig% förändring vid SLUTBESÖK |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-kolesterol (mg / dL) | |||||
| Baseline Genomsnittlig% förändring vid SLUTBESÖK |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-kolesterol (mg / dL) | |||||
| Baseline Genomsnittlig% förändring vid SLUTBESÖK |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
Till skillnad från sulfonylurea tenderade kroppsvikten hos Glucophage att förbli stabil eller till och med minska något (se Tabeller 2 och 3).
En 24-veckors, dubbelblind, placebokontrollerad studie av Glucophage plus insulin kontra insulin plus placebo var utförs hos patienter med typ 2-diabetes som inte lyckades uppnå tillräcklig glykemisk kontroll med insulin ensam (se Tabell 5). Patienter som slumpmässigt fick Glucophage plus insulin uppnådde en minskning av HbA1c på 2,10%, jämfört med en 1,56% reduktion i HbA1c uppnådd med insulin plus placebo. Förbättringen av glykemisk kontroll uppnåddes vid det slutliga studiebesöket med 16% mindre insulin, 93,0 U / dag vs 110,6 U / dag, Glucophage plus insulin kontra insulin plus placebo, p = 0,04.
Tabell 5: Kombinerad glukofag / insulin mot placebo / insulin Sammanfattning av medelförändringar från baslinjen i HbA1c och daglig insulindos
| Glucophage / Insulin (N = 26) |
Placebo/ Insulin (N = 28) |
Behandling Skillnad Medel ± SE |
|
|---|---|---|---|
|
en Statistiskt signifikant med användning av analys av kovarians med baslinjen som kovariat (p = 0,04) Inte signifikant med användning av variansanalys (värden visas i tabellen) | |||
| b Statistiskt signifikant för insulin (p = 0,04) | |||
| Hemoglobin A1c (%) | |||
| Baseline Ändra vid SLUTBESÖK |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43en |
| Insulindos (U / dag) | |||
| Baseline Ändra vid SLUTBESÖK |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77b |
En andra dubbelblind, placebokontrollerad studie (n = 51), med 16 veckors randomiserad behandling, visade att hos patienter med typ 2-diabetes kontrollerad med insulin under 8 veckor med en genomsnittlig HbA1c av 7,46 ± 0,97% upprätthöll tillsatsen av Glucophage liknande glykemisk kontroll (HbA1c 7,15 ± 0,61 vs 6,97 ± 0,62 för Glucophage plus insulin och placebo plus insulin med 19% mindre insulin jämfört med baslinjen (reduktion med 23,68 ± 30,22 mot en ökning med 0,43 ± 25,20 enheter för Glucophage plus insulin och placebo plus insulin, p <0,01). Dessutom visade denna studie att kombinationen av glukofag plus insulin resulterade i minskning i kroppsvikt på 3,11 ± 4,30 kg, jämfört med en ökning med 1,30 ± 6,08 pund för placebo plus insulin, p = 0,01.
Glucophage XR
En 24-veckors, dubbelblind, placebokontrollerad studie av Glucophage XR, som gjordes en gång dagligen med kvällsmåltiden, genomfördes i patienter med typ 2-diabetes som inte lyckats uppnå glykemisk kontroll med diet och träning (HbA1c 7,0% -10,0%, FPG 126-270 mg / dl). Patienter som deltog i studien hade en genomsnittlig baslinje HbA1c på 8,0% och en genomsnittlig baslinje-FPG på 176 mg / dL. Efter 12 veckors behandling hade medelhbA1c ökat från baslinjen med 0,1% och medel FPG minskat från baslinjen med 2 mg / dL i placebogruppen, jämfört med en minskning i medelhbA1c på 0,6% och en minskning i medel FPG på 23 mg / dL hos patienter som behandlades med Glucophage XR 1000 mg en gång dagligen. Därefter ökades behandlingsdosen till 1500 mg en gång dagligen om HbA1c var 7,0% men <8,0% (patienter med HbA1c - 8,0% avbröts från studien). Vid det sista besöket (24 veckor) hade medelhbA1c ökat 0,2% från baslinjen hos placebopatienter och minskade 0,6% med Glucophage XR.
En 16-veckors, dubbelblind, placebokontrollerad dosresponsstudie av Glucophage XR, en gång dagligen med kvällsmåltid eller två gånger dagligen med måltider, genomfördes hos patienter med typ 2-diabetes som inte lyckats uppnå glykemisk kontroll med diet och träning (HbA1c 7,0% -11,0%, FPG 126-280 mg / dl). Förändringar i glykemisk kontroll och kroppsvikt visas i tabell 6.
Tabell 6: Sammanfattning av genomsnittliga förändringar från baslinjen * i HbA1c, Fastande plasmaglukos och kroppsvikt vid slutbesöket (16-veckors studie)
| Glucophage XR | Placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg En gång Dagligen |
1000 mg En gång Dagligen |
1500 mg En gång Dagligen |
2000 mg En gång Dagligen |
1000 mg Dubbelt Dagligen |
||
| * Alla patienter på dietterapi vid baslinjen | ||||||
| en Alla jämförelser jämfört med Placebo | ||||||
| ** Inte statistiskt signifikant | ||||||
| Hemoglobin A1c (%) | (N = 115) | (N = 115) | (N = 111) | (N = 125) | (N = 112) | (N = 111) |
| Baseline | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Ändra vid SLUTBESÖK | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-värdeen | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (N = 126) | (N = 118) | (N = 120) | (N = 132) | (N = 122) | (N = 113) |
| Baseline | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Ändra vid SLUTBESÖK | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-värdeen | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Kroppsvikt (kg) | (N = 125) | (N = 119) | (N = 117) | (N = 131) | (N = 119) | (N = 113) |
| Baseline | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Ändra vid SLUTBESÖK | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-värdeen | NS ** | NS ** | NS ** | NS ** | NS ** | - |
Jämfört med placebo sågs förbättring i glykemisk kontroll vid alla dosnivåer av Glucophage XR (metformin hydroklorid) Tabletter med förlängd frisättning och behandling var inte associerad med någon signifikant viktförändring (ser DOSERING OCH ADMINISTRERING för doseringsrekommendationer för Glucophage och Glucophage XR).
En 24-veckors, dubbelblind, slumpmässig studie av Glucophage XR, en gång dagligen med kvällsmåltiden, och Glucophage (metforminhydroklorid) tabletter, tagna två gånger dagligen (med frukost och kvällsmåltid), genomfördes hos patienter med typ 2-diabetes som hade behandlats med Glucophage 500 mg två gånger dagligen i minst 8 veckor före studiens inträde. Glukofagdosen hade inte nödvändigtvis titrerats för att uppnå en specifik nivå av glykemisk kontroll före studiens inträde. Patienter kvalificerade sig för studien om HbA1c var 8,5% och FPG var 200 mg / dL. Förändringar i glykemisk kontroll och kroppsvikt visas i tabell 7.
Tabell 7: Sammanfattning av genomsnittliga förändringar från baslinjen * i HbA1c, Fastande plasmaglukos och kroppsvikt vid vecka 12 och vid slutbesök (24-veckors studie)
| Glucophage 500 mg Två gånger dagligen |
Glucophage XR | ||
|---|---|---|---|
| 1000 mg En gång om dagen |
1500 mg En gång om dagen |
||
| * Alla patienter på Glucophage 500 mg två gånger dagligen vid baslinjen | |||
| en n = 68 | |||
| Hemoglobin A1c (%) | (N = 67) | (N = 72) | (N = 66) |
| Baseline | 7.06 | 6.99 | 7.02 |
| Ändra vid 12 veckor | 0.14 | 0.23 | 0.04 |
| (95% Cl) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Ändra vid SLUTBESÖK | 0.14en | 0.27 | 0.13 |
| (95% Cl) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (N = 69) | (N = 72) | (N = 70) |
| Baseline | 127.2 | 131.0 | 131.4 |
| Ändra vid 12 veckor | 12.9 | 9.5 | 3.7 |
| (95% Cl) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Ändra vid SLUTBESÖK | 14.0 | 11.5 | 7.6 |
| (95% Cl) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Kroppsvikt (kg) | (N = 71) | (N = 74) | (N = 71) |
| Baseline | 210.3 | 202.8 | 192.7 |
| Ändra vid 12 veckor | 0.4 | 0.9 | 0.7 |
| (95% Cl) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Ändra vid SLUTBESÖK | 0.9 | 1.1 | 0.9 |
| (95% Cl) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
Efter 12 veckors behandling fanns en ökning i medelhbA1c i alla grupper; i gruppen Glucophage XR 1000 mg var ökningen från baslinjen på 0,23% statistiskt signifikant (se DOSERING OCH ADMINISTRERING).
Förändringar i lipidparametrar i den tidigare beskrivna placebokontrollerade dosresponsstudien av Glucophage XR visas i tabell 8.
Tabell 8: Sammanfattning av genomsnittliga procentuella förändringar från baslinjen * i större lipidvariabler vid slutbesök (16-veckors studie)
| Glucophage XR | Placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg En gång Dagligen |
1000 mg En gång Dagligen |
1500 mg En gång Dagligen |
2000 mg En gång Dagligen |
1000 mg Dubbelt Dagligen |
||
| * Alla patienter på dietterapi vid baslinjen | ||||||
| Totalt kolesterol (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Baseline | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Genomsnittlig% förändring vid SLUTBESÖK | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Totala triglycerider (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Baseline | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Genomsnittlig% förändring vid SLUTBESÖK | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-kolesterol (mg / dL) | (N = 119) | (N = 113) | (N = 109) | (N = 126) | (N = 117) | (N = 107) |
| Baseline | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Genomsnittlig% förändring vid SLUTBESÖK | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-kolesterol (mg / dL) | (N = 120) | (N = 108) | (N = 108) | (N = 125) | (N = 117) | (N = 108) |
| Baseline | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Genomsnittlig% förändring vid SLUTBESÖK | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Förändringar i lipidparametrar i den tidigare beskrivna studien av Glucophage och Glucophage XR visas i tabell 9.
Tabell 9: Sammanfattning av genomsnittliga procentuella förändringar från baslinjen * i stora lipidvariabler vid slutbesök (24-veckors studie)
| Glucophage | Glucophage XR | ||
|---|---|---|---|
| 500 mg Två gånger dagligen |
1000 mg En gång om dagen |
1500 mg En gång om dagen |
|
| * Alla patienter på Glucophage 500 mg två gånger dagligen vid baslinjen | |||
| Totalt kolesterol (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 199.0 | 201.9 | 201.6 |
| Genomsnittlig% förändring vid SLUTBESÖK | 0.1% | 1.3% | 0.1% |
| Totala triglycerider (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 178.0 | 169.2 | 206.8 |
| Genomsnittlig% förändring vid SLUTBESÖK | 6.3% | 25.3% | 33.4% |
| LDL-kolesterol (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 122.1 | 126.2 | 115.7 |
| Genomsnittlig% förändring vid SLUTBESÖK | −1.3% | −3.3% | −3.7% |
| HDL-kolesterol (mg / dL) | (N = 68) | (N = 70) | (N = 65) |
| Baseline | 41.9 | 41.7 | 44.6 |
| Genomsnittlig% förändring vid SLUTBESÖK | 4.8% | 1.0% | -2.1% |
Pediatriska kliniska studier
I en dubbelblind, placebokontrollerad studie på barn i åldrarna 10 till 16 år med typ 2-diabetes (medelvärde FPG 182,2 mg / dL), behandling med Glucophage (upp till 2000) mg / dag) i upp till 16 veckor (genomsnittlig behandlingstid 11 veckor) resulterade i en signifikant genomsnittlig nettoreduktion i FPG på 64,3 mg / dL, jämfört med placebo (se tabell 10).
Tabell 10: Glukofag vs Placebo (pediatriken) Sammanfattning av genomsnittliga förändringar från baslinjen * i plasmaglukos och kroppsvikt vid slutbesöket
| Glucophage | Placebo | p-värde | |
|---|---|---|---|
| en Pediatriska patienter har ålder 13,8 år (intervall 10-16 år) | |||
| * Alla patienter på dietterapi vid baslinjen | |||
| ** Inte statistiskt signifikant | |||
| FPG (mg / dL) | (N = 37) | (N = 36) | |
| Baseline Ändra vid SLUTBESÖK |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Kroppsvikt (kg) | (N = 39) | (N = 38) | |
| Baseline Ändra vid SLUTBESÖK |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
topp
Indikationer och användning
Glukofag (metforminhydroklorid) tabletter indikeras som ett komplement till kost och träning för att förbättra glykemisk kontroll hos vuxna och barn med typ 2-diabetes mellitus.
Glucophage XR (metforminhydroklorid) tabletter med förlängd frisättning indikeras som ett komplement till diet och träning för att förbättra glykemisk kontroll hos vuxna med typ 2-diabetes mellitus.
topp
Kontra
Glucophage och Glucophage XR är kontraindicerade hos patienter med:
Njursjukdom eller nedsatt njurfunktion (t.ex. som antyds av serumkreatininnivåer â ¥ 1,5 mg / dL [män], 1.4 ¥ 1,4 mg / dL [kvinnor] eller onormal kreatininclearance) som också kan vara ett resultat av tillstånd som hjärt-kärlkollaps (chock), akut hjärtinfarkt och septikemi (ser VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER).
Känd överkänslighet mot metforminhydroklorid.
Akut eller kronisk metabolisk acidos, inklusive diabetisk ketoacidos, med eller utan koma. Diabetisk ketoacidos bör behandlas med insulin.
Glucophage och Glucophage XR ska tillfälligt avbrytas hos patienter som genomgår radiologiska studier som involverar intravaskulär administration av joderade kontrastmaterial, eftersom användning av sådana produkter kan leda till akut förändring av njurfunktion. (Se även FÖRSIKTIGHETSÅTGÄRDER.)
topp
varningar
Mjölksyra:
Lactic acidosis är en sällsynt, men allvarlig, metabolisk komplikation som kan uppstå på grund av metforminansamling under behandling med Glucophage eller Glucophage XR; när det inträffar är det dödligt i cirka 50% av fallen. Laktic acidosis kan också uppstå i samband med ett antal patofysiologiska tillstånd, inklusive diabetes mellitus, och när det finns betydande vävnadshypoperfusion och hypoxemi. Mjölksyraos kännetecknas av förhöjda blodlaktatnivåer (> 5 mmol / L), minskat pH-värde i blod, elektrolytstörningar med ökat anjongap och ett ökat laktat / pyruvat-förhållande. När metformin impliceras som orsak till mjölksyraos, hittas vanligtvis metforminplasmanivåer> 5 | ig / ml.
Den rapporterade förekomsten av mjölksyraos hos patienter som får metforminhydroklorid är mycket låg (ungefär 0,03 fall / 1000 patientår, med cirka 0,015 dödliga fall / 1000 patientår). I mer än 20 000 patientårs exponering för metformin i kliniska studier fanns inga rapporter om mjölksyraos. Rapporterade fall har främst inträffat hos diabetespatienter med signifikant njurinsufficiens, inklusive båda intrinsiska njurarna sjukdom och njurhypoperfusion, ofta vid inställning av flera samtidigt medicinska / kirurgiska problem och flera samtidigt läkemedel. Patienter med hjärtsvikt som kräver farmakologisk behandling, särskilt de med instabilt eller akut hjärtsvikt som löper risk för hypoperfusion och hypoxemi, har en ökad risk för mjölkmedel acidos. Risken för mjölksyraos ökar med graden av nedsatt njurfunktion och patientens ålder. Därför kan risken för mjölksyraos minskas avsevärt genom regelbunden övervakning av njurfunktionen i patienter som tar Glucophage eller Glucophage XR och med användning av den minsta effektiva dosen Glucophage eller Glucophage XR. Behandlingen av äldre bör särskilt åtföljas av noggrann övervakning av njurfunktionen. Glucophage eller Glucophage XR-behandling bör inte påbörjas hos patienter på 80 år om inte mätning av kreatinin clearance visar att njurfunktionen inte reduceras, eftersom dessa patienter är mer mottagliga för att utveckla mjölksjukdom acidos. Dessutom bör Glucophage och Glucophage XR omedelbart hållas kvar i närvaro av något tillstånd som är förknippat med hypoxemi, uttorkning eller sepsis. Eftersom nedsatt leverfunktion kan betydligt begränsa förmågan att rensa laktat, glukofag och Glucophage XR bör i allmänhet undvikas hos patienter med kliniska eller laboratorieuppgifter om lever sjukdom. Patienter bör vara försiktiga mot överdrivet alkoholintag, antingen akut eller kronisk, när de tar Glucophage eller Glucophage XR, eftersom alkohol förstärker effekterna av metforminhydroklorid på laktat ämnesomsättning. Dessutom bör Glucophage och Glucophage XR tillfälligt avbrytas innan någon intravaskulär radiokontraststudie och för alla kirurgiska ingrepp (se även FÖRSIKTIGHETSÅTGÄRDER).
Uppkomsten av mjölksyraos är ofta subtil och åtföljs endast av ospecifika symtom som sjukdom, myalgier, andningsbesvär, ökande sömnighet och ospecifik buksbesvär. Det kan vara associerad hypotermi, hypotension och resistenta bradyarytmier med mer markerad acidos. Patienten och patientens läkare måste vara medvetna om den möjliga betydelsen av sådana symtom och patienten bör instrueras att meddela läkaren omedelbart om de uppstår (se även FÖRSIKTIGHETSÅTGÄRDER). Glucophage och Glucophage XR bör dras tillbaka tills situationen är klar. Serumelektrolyter, ketoner, blodglukos, och om indikerat, kan blodets pH, laktatnivåer och till och med blodmetforminnivåer vara användbara. När en patient har stabiliserats på någon dosnivå av glukofag eller glukofag XR, är troligt att gastrointestinala symtom, som är vanliga vid initiering av terapi, inte är läkemedelsrelaterade. Senare förekomst av gastrointestinala symtom kan bero på mjölksyra eller annan allvarlig sjukdom.
Nivåer för fastande venös plasmalaktat över den övre gränsen för normal men mindre än 5 mmol / L hos patienter som tar Glucophage eller Glucophage XR indikerar inte nödvändigtvis överhängande mjölksyraos och kan förklaras med andra mekanismer, såsom dålig kontrollerad diabetes eller fetma, kraftig fysisk aktivitet eller tekniska problem i provet hantering. (Se även FÖRSIKTIGHETSÅTGÄRDER.)
Laktisk acidos bör misstänkas hos alla diabetiker med metabolisk acidos som saknar bevis för ketoacidos (ketonuri och ketonemi).
Lactic acidosis är en medicinsk nödsituation som måste behandlas på sjukhus. Hos en patient med mjölksyraosos som tar Glucophage eller Glucophage XR, ska läkemedlet avbrytas omedelbart och allmänna stödåtgärder ska vidtas omedelbart. Eftersom metforminhydroklorid är dialyserbar (med en frigång på upp till 170 ml / min under bra hemodynamisk förhållanden), rekommenderas snabb hemodialys för att korrigera acidosen och ta bort den ackumulerade metformin. Sådan hantering leder ofta till snabb omvändning av symtom och återhämtning. (Se även KONTRA och FÖRSIKTIGHETSÅTGÄRDER.)
topp
försiktighetsåtgärder
Allmän
Makrovaskulära resultat - Det har inte gjorts några kliniska studier som visar slutgiltiga bevis på makrovaskulär riskreduktion med Glucophage eller Glucophage XR eller något annat antidiabetiskt läkemedel.
Övervakning av njurfunktion - Metformin är känt för att väsentligen utsöndras av njurarna och risken för ackumulering av metformin och mjölksyraos ökar med graden av nedsatt njurfunktion fungera. Således bör patienter med serumkreatininnivåer över den övre normala gränsen för deras ålder inte få glukofag eller glukofag XR. Hos patienter med avancerad ålder bör Glucophage och Glucophage XR noggrant titreras för att fastställa minimidosen för adekvat glykemisk effekt, eftersom åldrande är förknippat med nedsatt njurfunktion fungera. Hos äldre patienter, särskilt de som är 80 år, bör njurfunktionen övervakas regelbundet och i allmänhet ska glukofag och glukofag XR inte titreras till maximal dos (se VARNINGAR och DOSERING OCH ADMINISTRERING).
Innan Glucophage eller Glucophage XR-behandling påbörjas och minst en gång årligen därefter, bör njurfunktionen bedömas och verifieras som normalt. Hos patienter som förväntas utveckling av nedsatt njurfunktion bör njurfunktionen bedömas oftare och Glucophage eller Glucophage XR avbröts om tecken på nedsatt njurfunktion är närvarande.
Användning av samtidig medicinering som kan påverka njurfunktionen eller metformindisposition - Samtidig medicinering som kan påverka njurfunktionen eller resultera i betydande hemodynamisk förändring eller kan störa dispositionen av metformin, såsom katjoniska läkemedel som elimineras genom renal tubulär sekretion (se FÖRSIKTIGHETSÅTGÄRDER: Läkemedelsinteraktioner), bör användas med försiktighet.
Radiologiska studier innefattande användning av intravaskulära joderade kontrastmaterial (till exempel intravenöst urogram, intravenöst kolangiografi, angiografi och datortomografi (CT) genomsökningar med intravaskulära kontrastmaterial) —Intravaskulära kontraststudier med joderade material kan leda till akut förändring av njurfunktionen och har förknippats med mjölksyraos hos patienter som får metformin (se KONTRA). Därför bör Glucophage eller Glucophage XR tillfälligt avbrytas hos patienter i vilka en sådan studie planeras vid tidpunkten för eller före förfarande och kvarhålls i 48 timmar efter proceduren och återinförts först efter att njurfunktionen har utvärderats på nytt och visat sig vara vanligt.
Hypoxiska tillstånd - kardiovaskulär kollaps (chock) från vilken orsak som helst, akut kongestiv hjärtsvikt, akut hjärtinfarkt infarkt och andra tillstånd som kännetecknas av hypoxemi har förknippats med mjölksyraos och kan också orsaka prerenal azotemi. När sådana händelser inträffar hos patienter som behandlas med Glucophage eller Glucophage XR, bör läkemedlet omgående avbrytas.
Kirurgiska ingrepp - Glucophage eller Glucophage XR-behandling bör tillfälligt upphöra för varje kirurgiskt ingrepp (förutom mindre förfaranden som inte är associerade med begränsat intag av mat och vätskor) och bör inte startas om förrän patientens orala intag har återupptagits och njurfunktionen har utvärderats som vanligt.
Alkoholintag - alkohol är känt för att förstärka metformins effekt på laktatmetabolismen. Patienter bör därför varnas för överdrivet alkoholintag, akut eller kronisk, medan de får Glucophage eller Glucophage XR.
Nedsatt leverfunktion - Eftersom nedsatt leverfunktion har förknippats med vissa fall av mjölksyraos, Glucophage och Glucophage XR bör i allmänhet undvikas hos patienter med kliniska eller laboratorieuppgifter om lever sjukdom.
Vitamin B12-nivåer - I kontrollerade kliniska prövningar av glukofag med 29 veckors varaktighet, en minskning till subnormala nivåer av tidigare normala nivåer av vitamin B12 i serum, utan kliniska manifestationer, observerades hos cirka 7% av patienter. En sådan minskning, möjligen på grund av interferens med B12-absorption från det B12-intrinsiska faktorkomplexet, är emellertid mycket sällan förknippas med anemi och verkar snabbt vara reversibelt vid upphörande av glukofag eller vitamin B12 tillskott. Mätning av hematologiska parametrar på årsbasis rekommenderas hos patienter på Glucophage eller Glucophage XR och alla uppenbara avvikelser bör undersökas och hanteras på lämpligt sätt (se FÖRSIKTIGHETSÅTGÄRDER: Laboratorietester).
Vissa individer (de med otillräcklig vitamin B12 eller kalciumintag eller -absorption) verkar vara disponerade för att utveckla subnormala vitamin B12-nivåer. Hos dessa patienter kan rutinmässiga serum vitamin B12-mätningar med 2- till 3-års intervall vara användbara.
Förändring i klinisk status hos patienter med tidigare kontrollerad typ 2-diabetes — En patient med typ 2-diabetes som tidigare var väl kontrollerad på Glucophage eller Glucophage XR som utvecklar avvikelser från laboratorier eller klinisk sjukdom (särskilt vag och dåligt definierad sjukdom) bör utvärderas omgående för bevis på ketoacidos eller mjölksjukdom acidos. Utvärderingen bör inkludera serumelektrolyter och ketoner, blodglukos och, om indikerat, blodets pH, laktat, pyruvat och metforminnivåer. Om acidos av endera formen inträffar, måste Glucophage eller Glucophage XR omedelbart stoppas och andra lämpliga korrigerande åtgärder vidtas (se även VARNINGAR).
Hypoglykemi - Hypoglykemi förekommer inte hos patienter som får Glucophage eller Glucophage XR ensam under vanliga användningsförhållanden, men kan uppstå när kaloriintaget är bristfällig, när ansträngande träning inte kompenseras genom kaloritillskott, eller vid samtidig användning med andra glukos-sänkande medel (såsom sulfonylurea och insulin) eller etanol.
Äldre, försvagade eller undernärda patienter och patienter med binjurebildning eller hypofysen eller alkoholförgiftning är särskilt mottagliga för hypoglykemiska effekter. Hypoglykemi kan vara svår att känna igen hos äldre och hos personer som tar beta-adrenerga blockerande läkemedel.
Förlust av kontroll av blodglukos - När en patient som stabiliserats på något diabetesprogram utsätts för stress som feber, trauma, infektion eller operation, kan en tillfällig förlust av glykemisk kontroll uppstå. Vid sådana tillfällen kan det vara nödvändigt att hålla kvar Glucophage eller Glucophage XR och tillfälligt administrera insulin. Glucophage eller Glucophage XR kan återställas efter det att den akuta episoden har lösts.
Effekten av orala antidiabetiska läkemedel vid sänkning av blodglukos till en riktad nivå minskar hos många patienter under en tidsperiod. Detta fenomen, som kan bero på progression av den underliggande sjukdomen eller minskad lyhördhet mot läkemedlet, är känd som sekundär misslyckande, för att skilja det från primärt fel där läkemedlet är ineffektivt under initial terapi. Om sekundärt fel inträffar med antingen Glucophage eller Glucophage XR eller sulfonylurea monoterapi kan kombinerad behandling med Glucophage eller Glucophage XR och sulfonylurea resultera i ett svar. Skulle sekundär fel inträffa med kombinerad Glucophage / sulfonylurea-terapi eller Glucophage XR / sulfonylurea-terapi, det kan vara nödvändigt att överväga terapeutiska alternativ inklusive initiering av insulinterapi.
Information för patienter
Patienter ska informeras om de potentiella riskerna och fördelarna med Glucophage eller Glucophage XR och om alternativa behandlingsformer. De bör också informeras om vikten av att följa dietinstruktionerna, om en regelbunden övning och regelbundet test av blodglukos, glykosylerat hemoglobin, njurfunktion och hematolog parametrar.
Riskerna för mjölksyra, dess symtom och tillstånd som predisponerar för dess utveckling, som anges i VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER avsnitt, bör förklaras för patienter. Patienter bör rådas att avbryta Glucophage eller Glucophage XR omedelbart och omedelbart meddela sin hälsa utövare om oförklarlig hyperventilation, myalgi, malaise, ovanlig sömnighet eller andra icke-specifika symtom inträffa. När en patient har stabiliserats på någon dosnivå av glukofag eller glukofag XR, är troligt att gastrointestinala symtom, som är vanliga vid initiering av metforminbehandling, troligen inte är läkemedelsrelaterade. Senare förekomst av gastrointestinala symtom kan bero på mjölksyra eller annan allvarlig sjukdom.
Patienter bör rådas mot överdrivet alkoholintag, antingen akut eller kronisk, medan de får Glucophage eller Glucophage XR.
Glucophage eller Glucophage XR enbart orsakar vanligtvis inte hypoglykemi, även om det kan uppstå när Glucophage eller Glucophage XR används i samband med orala sulfonylurea och insulin. Vid initiering av kombinationsterapi, riskerna för hypoglykemi, dess symtom och behandling och villkor som predisponerar för dess utveckling bör förklaras för patienter och ansvarig familj medlemmar.
Patienterna ska informeras om att Glucophage XR måste sväljas hela och inte krossas eller tuggas, och att inaktiva ingredienser kan ibland elimineras i avföringen som en mjuk massa som kan likna originalet läsplatta.
Laboratorietester
Svaret på alla diabetiska behandlingar bör övervakas genom periodiska mätningar av fastande blod glukos- och glykosylerade hemoglobinnivåer, med målet att minska dessa nivåer mot det normala räckvidd. Under initial dostitrering kan fasta glukos användas för att bestämma det terapeutiska svaret. Därefter bör både glukos och glykosylerat hemoglobin övervakas. Mätningar av glykosylerat hemoglobin kan vara särskilt användbara för att utvärdera långsiktig kontroll (se även DOSERING OCH ADMINISTRERING).
Inledande och periodisk övervakning av hematologiska parametrar (t.ex. hemoglobin / hematokrit och rött blod) cellindex) och njurfunktion (serumkreatinin) bör utföras, åtminstone på årsbasis. Även om megaloblasticanemia sällan har setts med glukofagbehandling, om detta misstänks, bör vitamin B12-brist uteslutas.
Läkemedelsinteraktioner (klinisk utvärdering av läkemedelsinteraktioner utförda med glukofag)
Glyburide - I en engångsdos interaktionsstudie hos patienter av typ 2-diabetes, samtidigt administrering av metformin och glyburid resulterade inte i några förändringar i varken metformins farmakokinetik eller farmakodynamik. Minskningar i glyburid AUC och Cmax observerades men var mycket varierande. Den enstaka dosens natur i denna studie och bristen på korrelation mellan glyburid-blodnivåer och farmakodynamiska effekter gör den kliniska betydelsen av denna interaktion osäker (se DOSERING OCH ADMINISTRERING: Samtidig glukofag eller glukofag XR och oral sulfonylureaterapi hos vuxna patienter).
Furosemid - En engångsstudie med metformin-furosemid-läkemedelsinteraktion hos friska personer visade att farmakokinetiska parametrar för båda föreningarna påverkades av samtidig administrering. Furosemid ökade metforminplasma och Cmax i blod med 22% och AUC i blod med 15%, utan någon signifikant förändring av renal clearance av metformin. Vid administrering med metformin var Cmax och AUC för furosemid 31% respektive 12% mindre än när administrerad ensam, och den terminala halveringstiden minskade med 32%, utan någon signifikant förändring i furosemid-njuren undanröjning. Ingen information finns tillgänglig om interaktion mellan metformin och furosemid när den administreras tillsammans kroniskt.
Nifedipin - En enstaka dos, metformin-nifedipin läkemedelsinteraktionsstudie hos normala friska frivilliga visade att vid samtidig administrering av nifedipin ökade Cmax och metc-amin Cmax med 20% respektive 9% och ökade mängden utsöndras i urinen. Tmax och halveringstid påverkades inte. Nifedipin verkar öka absorptionen av metformin. Metformin hade minimala effekter på nifedipin.
Katjoniska läkemedel - katjoniska läkemedel (t.ex. amilorid, digoxin, morfin, prokainamid, kinidin, kinin, ranitidin, triamteren, trimetoprim eller vankomycin) som elimineras genom renal tubulär sekretion har teoretiskt potentialen för interaktion med metformin genom att tävla om vanlig renal tubulär transport system. Sådan interaktion mellan metformin och oral cimetidin har observerats hos normala friska frivilliga i både en- och multipeldos, metformin-cimetidin läkemedelsinteraktionsstudier, med en 60% ökning av maximal metforminplasma och helblodkoncentrationer och en 40% ökning av plasma och metblod av fullblod AUC. Det fanns ingen förändring i eliminationshalveringstiden i enkeldosstudien. Metformin hade ingen effekt på farmakokinetiken för cimetidin. Även om sådana interaktioner förblir teoretiska (med undantag för cimetidin), noggrann patientövervakning och dosjustering av Glucophage eller Glucophage XR och / eller det interfererande läkemedlet rekommenderas till patienter som tar katjoniska läkemedel som utsöndras via den proximala renala tubulära sekretionen systemet.
Andra - Vissa läkemedel tenderar att producera hyperglykemi och kan leda till förlust av glykemisk kontroll. Dessa läkemedel inkluderar tiazider och andra diuretika, kortikosteroider, fenotiaziner, sköldkörtelprodukter, östrogener, orala preventivmedel, fenytoin, nikotinsyra, sympatomimetika, kalciumkanalblockerande läkemedel och isoniazid. När sådana läkemedel administreras till en patient som får Glucophage eller Glucophage XR, bör patienten följas noggrant för förlust av blodsockerkontroll. När sådana läkemedel dras ut från en patient som får Glucophage eller Glucophage XR, bör patienten observeras noggrant för hypoglykemi.
Hos friska frivilliga personer påverkades inte farmakokinetiken för metformin och propranolol och metformin och ibuprofen när de administrerades samtidigt i interaktionsstudier med en dos.
Metformin är försumbart bundet till plasmaproteiner och är därför mindre benägna att interagera med mycket proteinbundna läkemedel såsom salicylater, sulfonamider, kloramfenikol och probenecid, jämfört med sulfonylurea, som i stor utsträckning är bundna till serum proteiner.
Karcinogenes, mutagenes, nedsatt fertilitet
Långtidsstudier av karcinogenicitet har utförts på råttor (doseringsvaraktighet 104 veckor) och möss (doseringsvaraktighet 91 veckor) vid doser upp till och med 900 mg / kg / dag och 1500 mg / kg / dag, respektive. Dessa doser är båda ungefär fyra gånger den maximala rekommenderade humana dagliga dosen på 2000 mg baserat på kroppsytans jämförelser. Inga bevis för karcinogenicitet med metformin hittades hos vardera han- eller kvinnliga möss. På liknande sätt observerades ingen tumörgenerisk potential med metformin hos hanråttor. Det fanns emellertid en ökad förekomst av godartade stromala livmoderpolyper hos honråttor behandlade med 900 mg / kg / dag.
Det fanns inga bevis på en mutagen potential av metformin i följande in vitro-test: Ames-test (S. typhimurium), genmutationstest (lymfomceller från mus) eller kromosomavvikelser (humana lymfocyter). Resultaten i mikronukleustest in vivo var också negativa.
Fertiliteten hos råttor av män eller kvinnor påverkades inte av metformin när de administrerades i doser så höga som 600 mg / kg / dag, vilket är ungefär 3 gånger den maximala rekommenderade dagliga dosen från människa baserat på kroppsytan jämförelser.
Graviditet
Teratogena effekter: Graviditetskategori B
Ny information tyder starkt på att onormala blodsockernivåer under graviditeten är förknippade med en högre förekomst av medfödda avvikelser. De flesta experter rekommenderar att insulin används under graviditet för att bibehålla blodsockernivåerna så nära det normala som möjligt. Eftersom studier på reproduktion av djur inte alltid förutsäger mänskligt svar, bör Glucophage och Glucophage XR inte användas under graviditet såvida det inte är klart nödvändigt.
Det finns inga adekvata och välkontrollerade studier på gravida kvinnor med Glucophage eller Glucophage XR. Metformin var inte teratogent hos råttor och kaniner i doser upp till 600 mg / kg / dag. Detta representerar en exponering på cirka 2 och 6 gånger den maximala rekommenderade humana dagliga dosen på 2000 mg baserat på kroppsytear jämförelser för råttor respektive kaniner. Bestämning av fosterkoncentrationer visade en partiell placentabarriär mot metformin.
Ammande mödrar
Studier på ammande råttor visar att metformin utsöndras i mjölk och når nivåer som är jämförbara med de i plasma. Liknande studier har inte utförts på ammande mödrar. Eftersom potentialen för hypoglykemi hos ammande spädbarn kan finnas, bör ett beslut fattas om man vill avbryta omvårdnad eller avbryta läkemedlet med hänsyn till läkemedlets betydelse för läkemedlet mor. Om Glucophage eller Glucophage XR avbryts och om dieten enbart är otillräcklig för att kontrollera blodsockret, bör insulinbehandling övervägas.
Pediatrisk användning
Säkerheten och effektiviteten hos Glucophage för behandling av typ 2-diabetes har fastställts i pediatriska patienter i åldrarna 10 till 16 år (studier har inte genomförts på pediatriska patienter under 10 år år). Användning av glukofag i denna åldersgrupp stöds av bevis från adekvata och välkontrollerade studier av glukofag hos vuxna med ytterligare data från en kontrollerad klinisk studie på pediatriska patienter i åldrarna 10 till 16 år med typ 2-diabetes, vilket visade ett liknande svar i glykemisk kontroll som det som ses i vuxna. (Ser KLINISK FARMAKOLOGI: Pediatriska kliniska studier.) I denna studie var biverkningarna liknande de som beskrivs hos vuxna. (Ser NEGATIVA REAKTIONER: Pediatriska patienter.) En maximal daglig dos på 2000 mg rekommenderas. (Ser DOSERING OCH ADMINISTRERING: Rekommenderat doseringsschema: Barnläkare.)
Säkerhet och effektivitet av Glucophage XR hos barn har inte fastställts.
Geriatrisk användning
Kontrollerade kliniska studier av Glucophage och Glucophage XR inkluderade inte tillräckligt antal äldre patienter för att avgöra om de svarar annorlunda än yngre patienter, även om annan rapporterad klinisk erfarenhet inte har identifierat skillnader i svar mellan äldre och yngre patienter. Metformin är känt för att väsentligen utsöndras av njurarna och eftersom risken för allvarliga biverkningar av läkemedlet är större hos patienter med nedsatt njurfunktion ska Glucophage och Glucophage XR endast användas till patienter med normal njurfunktion (se KONTRA, VARNINGAR, och KLINISK FARMAKOLOGI: Farmakokinetik). Eftersom åldrande är förknippat med nedsatt njurfunktion bör Glucophage eller Glucophage XR användas med försiktighet när åldern ökar. Försiktighet bör vidtas vid val av dos och bör baseras på noggrann och regelbunden övervakning av njurfunktionen. I allmänhet ska äldre patienter inte titreras till den maximala dosen Glucophage eller Glucophage XR (se även VARNINGAR och DOSERING OCH ADMINISTRERING).
topp
Negativa reaktioner
I en amerikansk dubbelblind klinisk studie av glukofag hos patienter med typ 2-diabetes fick totalt 141 patienter glukofagterapi (upp till 2550 mg per dag) och 145 patienter fick placebo. Biverkningar rapporterade hos mer än 5% av Glucophage-patienterna, och som var vanligare hos Glucophage än placebo-behandlade patienter, listas i tabell 11.
Tabell 11: Vanliga biverkningar (> 5,0 procent) i en placebokontrollerad klinisk studie av glukofagmonoterapi *
| Negativ reaktion | Glucophage monoterapi (N = 141) |
Placebo (N = 145) |
|---|---|---|
| % av patienterna | ||
| * Reaktioner som var vanligare hos patienter med glukofag än placebo. | ||
| Diarre | 53.2 | 11.7 |
| Illamående / kräkningar | 25.5 | 8.3 |
| gasbildning | 12.1 | 5.5 |
| asteni | 9.2 | 5.5 |
| Dålig matsmältning | 7.1 | 4.1 |
| Abdominalt obehag | 6.4 | 4.8 |
| Huvudvärk | 5.7 | 4.8 |
Diarré ledde till avbrott av studiemedicinen hos 6% av patienterna som behandlades med Glucophage. Följande biverkningar rapporterades dessutom hos â € 1,0% till â € 5,0% av glukofagpatienterna och rapporterades oftare med Glucophage än placebo: onormal avföring, hypoglykemi, myalgi, luddvad, dyspné, spikstörning, utslag, ökad svettning, smakstörning, obehag i bröstet, frossa, influensasyndrom, rodnad, hjärtklappning.
I globala kliniska studier har över 900 patienter med typ 2-diabetes behandlats med Glucophage XR i placebo- och aktivt kontrollerade studier. I placebokontrollerade studier administrerades 781 patienter Glucophage XR och 195 patienter fick placebo. Biverkningar rapporterade hos mer än 5% av Glucophage XR-patienterna, och som var vanligare hos Glucophage XR- än placebobehandlade patienter, listas i tabell 12.
Tabell 12: Vanliga biverkningar (> 5,0 procent) i placebokontrollerade studier av glukofag XR *
| Negativ reaktion | Glucophage XR (N = 781) |
Placebo (N = 195) |
|---|---|---|
| % av patienterna | ||
| * Reaktioner som var vanligare hos Glucophage XR- än placebobehandlade patienter. | ||
| Diarre | 9.6 | 2.6 |
| Illamående / kräkningar | 6.5 | 1.5 |
Diarré ledde till avbrott av studiemedicinen hos 0,6% av patienterna som behandlades med Glucophage XR. Följande biverkningar rapporterades dessutom hos â € 1,0% till â € 5,0% av Glucophage XR-patienter och rapporterades ofta med Glucophage XR än placebo: buksmärta, förstoppning, buk i distentionen, dyspepsi / halsbränna, flatulens, yrsel, huvudvärk, övre luftvägsinfektion, smak störning.
Pediatriska patienter
I kliniska prövningar med Glucophage hos pediatriska patienter med typ 2-diabetes var profilen av biverkningar lik den som observerades hos vuxna.
topp
Överdos
Överdosering av metforminhydroklorid har inträffat, inklusive intag av mängder större än 50 gram. Hypoglykemi rapporterades i cirka 10% av fallen, men ingen orsakssammanhang med metforminhydroklorid har fastställts. Laktatacidos har rapporterats i cirka 32% av fall av metformin-överdos (se VARNINGAR). Metformin är dialyserbar med en frigång på upp till 170 ml / min under goda hemodynamiska förhållanden. Därför kan hemodialys vara användbart för avlägsnande av ackumulerat läkemedel från patienter i vilka man misstänker överdosering av metformin.
topp
Dosering och administrering
Det finns ingen fast doseringsplan för hantering av hyperglykemi hos patienter med typ 2-diabetes med Glucophage eller Glucophage XR eller något annat farmakologiskt medel. Dosering av glukofag eller glukofag XR måste individualiseras utifrån både effektivitet och tolerans, samtidigt som de högsta rekommenderade dagliga doserna inte överskrids. Den maximala rekommenderade dagliga dosen Glucophage är 2550 mg hos vuxna och 2000 mg hos barn (10-16 år); den maximala rekommenderade dagliga dosen Glucophage XR hos vuxna är 2000 mg.
Glucophage ska ges i uppdelade doser med måltider medan Glucophage XR i allmänhet ska ges en gång dagligen med kvällsmåltiden. Glucophage eller Glucophage XR bör startas i en låg dos, med gradvis upptrappning av dosen, båda för att minska gastrointestinala biverkningar och för att möjliggöra identifiering av den minimidos som krävs för adekvat glykemisk kontroll av patienten.
Under behandlingsstart och dostitrering (se rekommenderat doseringsschema nedan), bör fastande plasmaglukos vara används för att bestämma det terapeutiska svaret på Glucophage eller Glucophage XR och identifiera den minsta effektiva dosen för patient. Därefter bör glykosylerat hemoglobin mätas med intervaller på cirka 3 månader. Det terapeutiska målet borde vara att minska både fastande plasmaglukos och glykosylerat hemoglobinnivå till normalt eller nära normalt med med den lägsta effektiva dosen Glucophage eller Glucophage XR, antingen när den används som monoterapi eller i kombination med sulfonylurea eller insulin.
Övervakning av blodglukos och glykosylerat hemoglobin möjliggör också detektering av primärt fel, dvs otillräcklig sänkning av blodglukos vid maximal rekommenderad dos av medicinering, och sekundär misslyckande, dvs förlust av ett adekvat blodsockersänkande svar efter en initial period av effektivitet.
Kortvarig administration av Glucophage eller Glucophage XR kan vara tillräckligt under perioder med kortvarig förlust av kontroll hos patienter som vanligtvis är välkontrollerade på dieten ensam.
Glucophage XR-tabletter måste sväljas hela och aldrig krossas eller tuggas. Ibland elimineras de inaktiva ingredienserna i Glucophage XR i avföringen som en mjuk, hydratiserad massa.
Rekommenderat doseringsschema
vuxna
I allmänhet ses inte kliniskt signifikanta svar vid doser under 1500 mg per dag. En lägre rekommenderad startdos och gradvis ökad dos rekommenderas dock för att minimera gastrointestinala symtom.
Den vanliga startdosen Glucophage (metforminhydroklorid) tabletter är 500 mg två gånger dagligen eller 850 mg en gång om dagen, ges vid måltiderna. Dosökningar bör göras i steg om 500 mg varje vecka eller 850 mg varannan vecka, upp till totalt 2000 mg per dag, ges i uppdelade doser. Patienter kan också titreras från 500 mg två gånger om dagen till 850 mg två gånger om dagen efter 2 veckor. För de patienter som behöver ytterligare glykemisk kontroll kan Glucophage ges till en maximal daglig dos på 2550 mg per dag. Doser över 2000 mg kan tolereras bättre ges 3 gånger om dagen med måltider.
Den vanliga startdosen av Glucophage XR (metforminhydroklorid) tabletter med förlängd frisättning är 500 mg en gång dagligen med kvällsmåltiden. Dosökningar bör göras i steg om 500 mg varje vecka, upp till maximalt 2000 mg en gång dagligen med kvällsmåltiden. Om glykemisk kontroll inte uppnås på Glucophage XR 2000 mg en gång dagligen, bör en försök med Glucophage XR 1000 mg två gånger dagligen övervägas. Om högre doser av metformin krävs, bör glukofag användas vid totala dagliga doser upp till 2550 mg administrerade i uppdelade dagliga doser, såsom beskrivs ovan. (Ser KLINISK FARMAKOLOGI: Kliniska studier.)
I en randomiserad studie överfördes patienter som för närvarande behandlas med Glucophage till Glucophage XR. Resultaten av denna studie tyder på att patienter som får Glucophage-behandling säkert kan bytas till Glucophage XR en gång dagligen med samma totala dagliga dos, upp till 2000 mg en gång dagligen. Efter en övergång från Glucophage till Glucophage XR, bör glykemisk kontroll övervakas noggrant och dosjusteringar göras i enlighet med detta (se KLINISK FARMAKOLOGI: Kliniska studier).
Pediatrik
Den vanliga startdosen Glucophage är 500 mg två gånger om dagen, ges vid måltiderna. Dosökningar bör göras i steg om 500 mg varje vecka upp till maximalt 2000 mg per dag, ges i uppdelade doser. Säkerhet och effektivitet av Glucophage XR hos barn har inte fastställts.
Överföring från annan antidiabetisk behandling
Vid överföring av patienter från andra orala hypoglykemiska ämnen än klorpropamid till glukofag eller glukofag XR är i allmänhet ingen övergångsperiod nödvändig. Vid överföring av patienter från klorpropamid bör försiktighet utövas under de första två veckorna på grund av långvarig retention av klorpropamid i kroppen, vilket leder till överlappande läkemedelseffekter och möjlig hypoglykemi.
Samtidig glukofag eller glukofag XR och oral sulfonylurea terapi hos vuxna patienter
Om patienterna inte har svarat på fyra veckor av den maximala dosen Glucophage eller Glucophage XR monoterapi bör hänsyn tas till gradvis tillsats av en oral sulfonylurea under fortsättning av Glucophage eller Glucophage XR vid den maximala dosen, även om tidigare primär eller sekundär brist på en sulfonylurea har inträffade. Kliniska och farmakokinetiska läkemedelsinteraktionsdata är för närvarande endast tillgängliga för metformin plus glyburid (glibenklamid).
Med samtidig Glucophage eller Glucophage XR och sulfonylurea-terapi kan den önskade kontrollen av blodglukos erhållas genom att justera dosen för varje läkemedel. I en klinisk prövning av patienter med typ 2-diabetes och tidigare fel på glyburid, patienter startade med Glucophage 500 mg och 20 mg glyburid titrerades till 1000/20 mg, 1500/20 mg, 2000/20 mg eller 2500/20 mg Glucophage respektive glyburid för att nå målet om glykemisk kontroll mätt med FPG, HbA1c och plasmaglukosrespons (ser KLINISK FARMAKOLOGI: Kliniska studier). Emellertid bör man försöka identifiera den minsta effektiva dosen av varje läkemedel för att uppnå detta mål. Vid samtidig Glucophage eller Glucophage XR och sulfonylurea-behandling fortsätter risken för hypoglykemi i samband med sulfonylurea-terapi och kan öka. Lämpliga försiktighetsåtgärder bör vidtas. (Se paketinsats av respektive sulfonylurea.)
Om patienterna inte har svarat tillfredsställande på 1 till 3 månaders samtidig behandling med maximal dos Glucophage eller Glucophage XR och maximal dos av en oral sulfonylurea, överväg terapeutiska alternativ inklusive växling till insulin med eller utan Glucophage eller Glucophage XR.
Samtidig glukofag eller glukofag XR och insulinbehandling hos vuxna patienter
Den aktuella insulindosen bör fortsätta efter inledande av Glucophage eller Glucophage XR-behandling. Glucophage eller Glucophage XR-behandling bör initieras med 500 mg en gång dagligen hos patienter som får insulinbehandling. För patienter som inte svarar tillräckligt bör dosen Glucophage eller Glucophage XR höjas med 500 mg efter ungefär en vecka och med 500 mg varje vecka därefter tills tillräcklig glykemisk kontroll är uppnått. Den maximala rekommenderade dagliga dosen är 2500 mg för Glucophage och 2000 mg för Glucophage XR. Det rekommenderas att insulindosen minskas med 10% till 25% vid fastande av plasmaglukos koncentrationerna minskar till mindre än 120 mg / dL hos patienter som får samtidig insulin och glukofag eller Glucophage XR. Ytterligare justering bör individualiseras baserat på glukos-sänkande svar.
Specifika patientpopulationer
Glucophage eller Glucophage XR rekommenderas inte för användning under graviditet. Glukofag rekommenderas inte för patienter under 10 år. Glucophage XR rekommenderas inte till barn (under 17 år).
Den initiala och underhållsdoseringen av Glucophage eller Glucophage XR bör vara konservativ hos patienter med avancerad ålder på grund av potentialen för minskad njurfunktion i denna population. Alla dosjusteringar bör baseras på en noggrann bedömning av njurfunktionen. I allmänhet ska äldre, försvagade och undernärda patienter inte titreras till den maximala dosen Glucophage eller Glucophage XR.
Övervakning av njurfunktionen är nödvändig för att hjälpa till att förebygga mjölksyra, särskilt hos äldre. (Ser VARNINGAR.)
topp
Hur levereras
Glucophage® (metforminhydroklorid) tabletter
| 500 mg | Flaskor på 100 | NDC 0087-6060-05 |
| 500 mg | Flaskor på 500 | NDC 0087-6060-10 |
| 850 mg | Flaskor på 100 | NDC 0087-6070-05 |
| 1000 mg | Flaskor på 100 | NDC 0087-6071-11 |
Glucophage 500 mg tabletter är runda, vita till benvita, filmdragerade tabletter präglade med "BMS 6060 "runt surfplattans periferi på ena sidan och" 500 "präglad över den andra sida.
Glucophage 850 mg tabletter är runda, vita till benvita, filmdragerade tabletter präglade med "BMS 6070 "runt surfplattans periferi på ena sidan och" 850 "präglad över den andra sida.
Glucophage 1000 mg tabletter är vita, ovala, bikonvexa, filmdragerade tabletter med "BMS 6071" präglade på ena sidan och "1000" präglade på motsatt sida och med en halverad linje på båda sidor.
Glucophage® XR (metforminhydroklorid) tabletter med förlängd frisättning
| 500 mg | Flaskor på 100 | NDC 0087-6063-13 |
| 750 mg | Flaskor på 100 | NDC 0087-6064-13 |
Glucophage XR 500 mg tabletter är vita till benvit, kapselformade, bikonvexa tabletter, med "BMS 6063" präglade på ena sidan och "500" präglade över ansiktet på den andra sidan.
Glucophage XR 750 mg tabletter är kapselformade, bikonvexa tabletter, med "BMS 6064" präglade på ena sidan och "750" präglade på andra sidan. Tabletterna är ljusröda och kan ha ett fläckigt utseende.
Lagring
Förvara vid 20 - 25 ° C (68 ° - 77 ° F); utflykter tillåtna till 15 ° -30 ° C (59 ° -86 ° F). [Se USP-kontrollerad rumstemperatur.]
Dispenser i ljusbeständiga behållare.
Glucophage® är ett registrerat varumärke som tillhör Merck Santà © S.A.S., associerat till Merck KGaA i Darmstadt, Tyskland. Licensierat till Bristol-Myers Squibb Company.
Levererad av:
Bristol-Myers Squibb Company
Princeton, NJ 08543 USA
senaste uppdatering: 01/2009
Glukohage, metforminhydroklorid, patientinformation (på vanligt engelska)
Detaljerad information om tecken, symtom, orsaker, behandling av diabetes
Informationen i denna monografi är inte avsedd att täcka alla möjliga användningar, anvisningar, försiktighetsåtgärder, läkemedelsinteraktioner eller negativa effekter. Denna information är generaliserad och är inte avsedd som specifik medicinsk rådgivning. Om du har frågor om läkemedlen du tar eller vill ha mer information, kontakta din läkare, apotekspersonal eller sjuksköterska.
tillbaka till: Bläddra bland alla mediciner för diabetes



